
分析 (1)根据氯元素有三种同位素35Cl、37Cl,它们两两结合成Cl2分子,相对分子质量等于质量数之和进行判断;
(2)元素的相对原子质量等于其所有核素的质量取加权平均数,据此回答.
解答 解:(1)根据氯元素有2种同位素35Cl、37Cl,它们两两结合成Cl2分子有三种,分别是:35Cl37Cl、35Cl2、37Cl2,它们的相对分子质量分别是70、72、74,故答案为:3;70、72、74;
(2)氯元素的两种天然同位素中,3517Cl约占75%,3717Cl约占25%,元素的质量是把其所有核素的质量取加权平均数,所谓取加权平均数就是考虑各种质量核素所占百分比,Cl元素的相对原子质量等于35×75%+37×25%=35.5,
故答案为:氯元素的两种天然同位素中,3517Cl约占75%,3717Cl约占25%,元素的质量是把其所有核素的质量取加权平均数,所谓取加权平均数就是考虑各种质量核素所占百分比,Cl元素的相对原子质量等于35×75%+37×25%=35.5.
点评 本题考查学生同位素、核素以及物质的分子构成和核素之间的关系知识,注意元素的相对原子质量和该元素各种核素的相对原子质量之间的关系是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,4.6g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| B. | 25℃时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.01NA | |
| C. | 1L 0.1mol•L-1 K2CO3溶液中,阴离子数目大于0.1NA | |
| D. | 2molSO2和1molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应生成NaOH和H2,推测:所有金属与水反应都生成碱和H2 | |
| B. | 由CO2+Ca(ClO)2+H2O═CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O═CaSO3↓+2HClO | |
| C. | 铝和硫直接化合能得到Al2S3,推测:铁和硫直接化合也能得到 Fe2S3 | |
| D. | 由Na2CO3+2HCl═2NaCl+H2O+CO2↑,推测:Na2SO3+2HCl═2NaCl+H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间所发生的碰撞都为有效碰撞 | |
| B. | 合成氨工业中用铁触媒做催化剂能用勒夏特列原理解释 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数 | |
| D. | 将钢闸门与电源的正极相连,是采用了外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
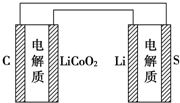 已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )
已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生还原反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 如图表示用锂离子电池给锂硫电池充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
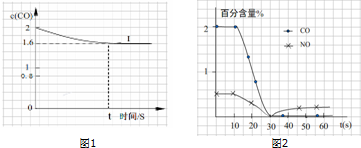
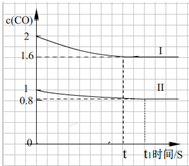 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com