
【题目】在晶体:干冰、金刚石、金属钠中,其构成微粒之间的作用力分别是、、 . 其中熔点最高的是 , 最低的是 .
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】(I)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:

请回答下列问题:
(1)盛装双氧水的化学仪器名称是__________。
(2)如何检验该套装置的气密性__________。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而__________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入______g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确_______,理由是__________。(提示:H2O2的密度可认为近似相等)。
(II)在如图所示的量热计中,将100mL0.50mol/LCH3COOH溶液与100mL0.55mol/LNaOH溶液混合。温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J/℃生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似为1g/mL。

(1)试求CH3COOH的中和热△H=__________。
(2)CH3COOH的中和热的文献值为56.1kJ/mol,则请你分析在(1)中测得的实验值偏差可能的原因_____________。
(3)实验中NaOH过量的目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,有一种反应类型与其他3种反应类型不同的是( )
A.CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
B.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列单质与盐溶液混合能发生反应,并且单质可以把盐中某元素置换出来的是( )
A. Na和ZnSO4溶液 B. Fe和AgNO3溶液 C. Cu和FeCl3溶液 D. F2和NaBr溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性
mol·L-1,说明该溶液呈中性
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对物质性质的研究是一种科学探究的过程,这种研究过程的科学组合应该是( )
A. 预测物质的性质→观察物质的外观→实验和观察→解释和结论
B. 观察物质的外观→预测物质的性质→解释和结论→实验和观察
C. 预测物质的性质→观察物质的外观→解释和结论→实验和观察
D. 观察物质的外观→预测物质的性质→实验和观察→解释和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( ) 
A.2:1
B.4:1
C.1:1
D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________。
(3)E的最高价氧化物分子的空间构型是__________,是____分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________。(a)中E原子的配位数为____。若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有____个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)____(b)(填“>”“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F,原子序数依次递增。已知:A、B、D、C的价电子数依次增多,其中C元素的原子半径最小;A有两个单电子,E的未成对电子数是前四周期中最多的,且其外围电子数与D相同,F的最外层电子数为2,内层全部排满。请用对应的元素符号回答下面的问题:
(1)写出E的价电子排布式:__________________________________________。
(2)在A形成的化合物中,A采取sp2杂化,且分子量最小的化合物为(写化学式)_____________________, 键角约为_____________________________________。
(3)下列物质的性质与氢键有关的是__________________________________________
A. 可燃冰的形成 B. A的氢化物的沸点 C. B的氢化物的热稳定性
(4)E3+可以与AB-形成配离子,其中E3+以d2sp3方式杂化,杂化轨道全部用来与AB-形成配位键,则E3+的配位数为________,1mol该配离子中含有_____________molσ 键。
(5)在C和D形成的化合物中,中心原子没有孤电子对的分子的空间构型为__________。
(6)根据下列图片说明为什么同周期过渡金属第一电离能变化没有主族元素变化明显__________________________________________。

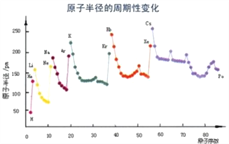
(7)F与D形成的化合物晶胞如图,F的配位数为_____________,晶体密度为a g/cm3,NA为阿伏加德罗常数,则晶胞边长为__________________pm。(1pm=10-10cm)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com