
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Al3+和K+ . 取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCL溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
A.至少存在5种离子
B.Cl﹣一定存在,且 c (Cl﹣)>0.4mol/L
C.SO42﹣、NH4+、一定存在,Cl﹣可能不存在
D.CO32﹣、Al3+﹣定不存在,K+可能存在
【答案】B
【解析】解:由于加入过量NaOH溶液,加热,得到0.02mol气体,说明一定有NH4+ , 且物质的量为0.02mol;同时产生红褐色沉淀,说明一定有Fe3+ , 1.6g固体为氧化铁,物质的量为0.01mol,故有0.02molFe3+ , 一定没有CO32﹣; 4.66g不溶于盐酸的沉淀为硫酸钡,一定有SO42﹣ , 物质的量为0.02mol;根据电荷守恒,必须还有阴离子,因此一定有Cl﹣ , 至少0.02mol×3+0.02﹣0.02mol×2=0.04mol,物质的量浓度至少 ![]() =0.4mol/L,
=0.4mol/L,
A、至少存在Cl﹣、SO42﹣、NH4+、Fe3+四种离子,故A错误;
B、根据电荷守恒,至少存在0.04molCl﹣ , c (Cl﹣)>0.4mol/L故B正确;
C、一定存在氯离子,故C错误;
D、Al3+无法判断是否存在,故D错误;
故选B.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】已知(HF)2(g)2HF(g),△H>0且平衡体系的总质量【m(总)】与总物质的量【n总】之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( ) 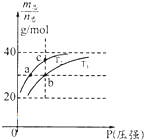
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:Vb>Va
D.当 ![]() =30g/mol时,n(HF):n[(HF)2]=2:1
=30g/mol时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合图所示情况的是( )
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2g Cu跟30.0mL 10.0molL﹣1的HNO3充分反应,还原产物有NO和NO2 , 若反应后溶液中有a mol H+ , 则此时溶液中含NO3﹣的物质的量为( )
A.0.5a mol
B.(0.1+a)mol
C.0.1a mol
D.2a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气或水体中的污染物。下列有关该金属氧化物应用的叙述不正确的是( )
A.将形成酸雨的SO2氧化为SO3
B.将家居装修挥发出的甲醛氧化为CO2和H2O
C.将医药废水中的苯酚氧化成H2O和CO2
D.将电镀废水中的氰根离子CN-氧化成CO2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水与久置的氯水相比较,下列结论不正确的是 ( )
A. 颜色相同 B. 前者能使有色布条褪色
C. 都含有H+ D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不污染空气。下列说法中错误的是( )
A.紫色石蕊溶液变蓝色
B.品红溶液褪色
C.溴水的橙色褪去
D.含酚酞的NaOH溶液红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】你认为减少酸雨产生的途径可采取的措施是( )
①减少煤作燃料 ②造高工厂烟囱 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A. ①②③B. ②③④⑤C. ①③⑤D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是。
(2)该反应中,发生还原反应的过程是→。
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目:。
(4)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com