
| A. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| D. | A1型、A3型结构为最密堆积;则A2型结构也为最密堆积 |
分析 A.氢化物的相对分子质量越大,沸点越高,分子间含有氢键的沸点较高;
B.元素的非金属性越强,其氢化物越稳定;
C.金属晶体由金属阳离子和自由电子构成;
D.面心立方堆积(A1型),六方最密堆积(A3型),体心立方堆积(A2型).
解答 解:A.氢化物的相对分子质量越大,沸点越高,分子间含有氢键的沸点较高,ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;而NH3分子间存在氢键沸点较高,所以ⅤA族元素氢化物沸点顺序也是NH3>AsH3>PH3,故A错误;
B.元素的非金属性越强,其氢化物越稳定,非金属性:F>O>N,Cl>S>P,所以第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3,故B正确;
C.晶体中有阴离子,必有阳离子,而金属晶体由金属阳离子和自由电子构成,所以晶体中有阳离子,不一定有阴离子,故C错误;
D.面心立方堆积(A1型)和六方最密堆积(A3型)都是最密堆积,体心立方堆积(A2型)不是最密堆积,故D错误.
故选B.
点评 本题考查了氢化物的沸点比较、氢化物的稳定性、晶体的构成、晶体结构等,题目难度中等,类推是学习化学的一种方法,但盲目类推又可能得出错误结论,注意物质性质的区别,不能以偏概全.


科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有①②③ | C. | 只有①③④ | D. | 除⑤外 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
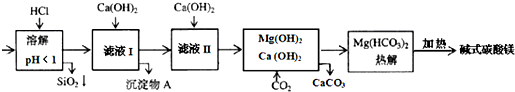
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| (溶度积)KSP | 4.0×10-38 | 1.25×10-33 | 1.8×10-11 |
| A. | 在滤液I中,加过量的Ca(OH)2使Fe3+和Al3+沉淀完全 | |
| B. | 滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全 | |
| C. | 室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全 | |
| D. | 若碱式碳酸镁【aMgCO3•b Mg(OH)2】高温加热分解得到6.6g CO2和8.0g MgO,由此可知其化学式为MgCO3•3Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B两种元素可组成化学式为BA2的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F | |
| D. | 气态氢化物的稳定性由强到弱的顺序是C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al与NaOH溶液的反应:Al3++3OH-=Al (OH) 3↓ | |
| B. | CaCl2溶液与Na2CO3溶液反应:Ca2++CO32-=CaCO3↓ | |
| C. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | CaCO3与稀盐酸反应:CO32-+2 H+=H2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com