
【题目】在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)△H 已知CH4的转化率与温度、压强的关系如图所示.回答下列问题: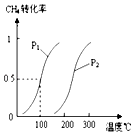
(1)100℃时平衡常数为 .
(2)图中的p1p2(填“<”、“>”或“=”),其理由是:
(3)若100℃时该可逆反应的平衡常数是K1 , 200℃该该可逆反应的平衡常数是K2 , 则K1K2(填“<”、“>”或“=”).其理由是 .
【答案】
(1)2.25×10﹣4 mol2?L﹣2
(2)<;相同温度时p1下CH4的转化率大于p2下CH4的转化率,由反应为气体体积增大的反应,压强越小转化率越高
(3)<;据图象可知,该可逆反应的△H>0,温度升高,平衡正向移动
【解析】解:(1)由图可知,100℃时CH4的转化率为0.5,则
CH4(g)+ | H2O(g) | CO(g)+ | 3H2(g) | |
起始 | 1 | 2 | 0 | 0 |
转化 | 0.5 | 0.5 | 0.5 | 1.5 |
平衡 | 0.5 | 1.5 | 0.5 | 1.5 |
K= 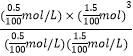 =2.25×10﹣4 mol2L﹣2,
=2.25×10﹣4 mol2L﹣2,
所以答案是:2.25×10﹣4 mol2L﹣2;(2)图中温度相同时,p1对应的转化率大,由反应为气体体积增大的反应,压强越小转化率越高,则p1<p2,
所以答案是:<;相同温度时p1下CH4的转化率大于p2下CH4的转化率,由反应为气体体积增大的反应,压强越小转化率越高;(3)图中压强相同时,温度越高,转化率越大,则该可逆反应的△H>0,温度越高,K越大,则K1<K2,
所以答案是:<;据图象可知,该可逆反应的△H>0,温度升高,平衡正向移动.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是短周期周期表的一部分①~⑨是元素周期表的部分元素。

请回答下列问题:
(1) ③、⑤、⑥对应的原子半径最大的是_____(写元素名称)
(2)元素⑤和⑧形成的化合物的电子式是_____,该化合物溶于水被破杯的化学键类型为_______。
(3)元素⑥和⑨的最高价氧化物对应的水化物发生反应的离子方程式是________。
(4)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一稗常见的氧化剂,已知液态A与液态B充分反应生成已知液态10电子分子和一种气态单质,写出A与B反应的化学方程式:______________。
(5)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:

①溶液c的作用是____________。
②溶液b是(填化学式)_____。写出溶液b中发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A.1:2
B.1:4
C.3:4
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法不正确的是( )
A.除去Na2CO3固体中少量NaHCO3:加热
B.除去CO2中少量SO2:通过饱和NaHCO3溶液
C.除去氯气中少量氯化氢:通过氢氧化钠溶液
D.除去氧化铁中少量氧化铝:加入过量的烧碱溶液后,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组对采集的酸雨样品进行化验,测得数据如下:c(Na+)=5.0×10-6 mol/L、c(NH4+)=2.0×10-5 mol/L、c(NO3-)=2.0×10-4 mol/L、c(SO42-)=4.0×10-4 mol/L,H+和OH-浓度未测定,则此酸雨的pH约为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.光合作用是将光能转化为化学能的有效途径
B.煤,石油,天然气都是可再生的化石燃料
C.用植物秸秆制沼气是有效利用生物质能的方式之一
D.开发氢能,太阳能,风能,生物质能等是实现“低碳生活”的有效途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质 | X | Y | Z |
初始浓度/(molL﹣1) | 0.1 | 0.2 | 0 |
2min末浓度/(molL﹣1) | 0.08 | a | b |
平衡浓度/(molL﹣1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为5%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池广泛应用于电动自行车电源,其工作原理如图所示,LixC6和Li1-xFePO4为电极材料,电池反应式为: LixC6+Li1-xFePO4=LiFePO4+6C(x<1)。下列说法错误的是
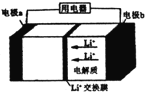
A. 放电时,电极b是负极
B. 放电时,电路中通过0.2mol电子,正极会增重1.4g
C. 充电时,电极a的电极反应式为:6C+xLi++xe-=LixC6
D. 若Li1-xFePO4电极中混有铁单质,会造成电池短路
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com