
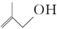 的分子式为:C4H8O.
的分子式为:C4H8O.  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
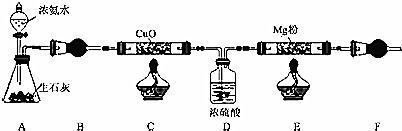
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
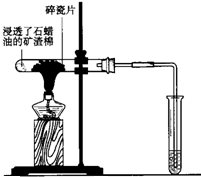 如图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体.利用该气体进行实验:
如图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体.利用该气体进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
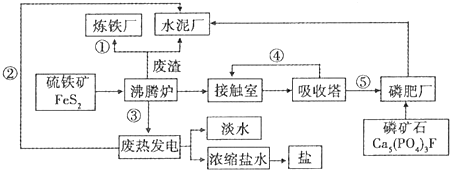
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
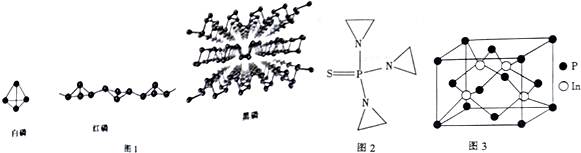
| A. | 电子层数:P<S<Cl | B. | 最高正化合价:N<O<F | ||
| C. | 原子半径:C<N<O | D. | 金属性:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是一种清洁能源 | B. | CH4•nH2O是一种离子化合物 | ||
| C. | 可燃冰在常温常压下能稳定存在 | D. | 可燃冰是天然气冷却后得到的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素的单质在常温下均为金属晶体 | |
| C. | 金属元素在不同的化合物中的化合价均不同 | |
| D. | 金属元素在一般化合物中只显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 与 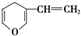 互为同分异构体的芳香族化合物有5种 互为同分异构体的芳香族化合物有5种 | |
| C. | 结构简式为 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| D. | 菲的结构简式为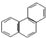 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com