
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
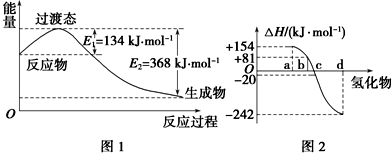
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)①根据△H=反应物总键能-生成物总键能计算;
②根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式;
(3)盖斯定律盖斯定律盖斯定律的含义是反应热是状态函数,与反应途径无关,根据目标方程式将已知的热化学方程式运用叠加的方法,得到目标方程式,反应热作相应的运算
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量为:368-134=234kJ,
反应热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1 .
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1 ;
(2)①△H=436kJ/mol+247kJ/mol-2E(H-Cl)=-185kJ/mol,解得:E(H-Cl)=434kJ/mol,
故答案为:434;
②非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O;
b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol;
(3)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ/mol,
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ/mol,
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ/mol,
根据盖斯定律(3×①-②-2×③)×$\frac{1}{6}$得:Fe(s)+CO(g)═Fe(s)+CO2(g)△H=$\frac{-82×3-(-47)-(+19)×2}{6}$KJ/mol=-11KJ/mol,
故答案为:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.
点评 本题考查了盖斯定律在热化学方程式中的应用,题目难度中等,明确盖斯定律的概念及含义为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸 纯碱 孔雀石[Cu2(OH)2CO3] | B. | 硝酸 烧碱 硫酸钡 | ||
| C. | 醋酸 乙醇 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
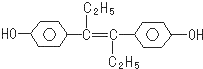
| A. | 己烯雌酚分子中碳原子的杂化轨道方式有sp2和sp3两种 | |
| B. | 己烯雌酚分子中所有的原子都可能在一个平面内 | |
| C. | 1mol己烯雌酚分子与溴水完全反应时,最多可消耗5molBr2 | |
| D. | 1mol己烯雌酚分子与氢气在一定条件下完全反应时,最多可消耗7molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$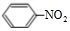 +H2O.
+H2O. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
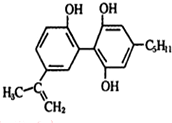 ,有关该物质的说法正确的是( )
,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4酸性溶液,观察到紫色褪去,可证明分子中存在双键 | |
| C. | 1mol该物质与足量的碳酸氢钠反应,产生3molCO2 | |
| D. | 1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| B. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| C. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| D. | 含大量Fe3+的溶液中:K+、I-、NH4+、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com