
| 碾碎后加入试剂1 |
| 隔绝空气静置过滤 |
| KSCN |
| 新制 |
| 氨水 |
| 一段 |
| 时间后 |


科目:高中化学 来源: 题型:
 的高聚物.而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物.而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )A、 |
B、 |
| C、CH3-CH2-CH2Cl |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光化学烟雾的产生与汽车排放的尾气有关 |
| B、人们用电动自行车代替摩托车是“低碳消费”的行为 |
| C、酸雨是指PH小于7的酸性降水,主要是由煤的燃烧所致的 |
| D、用Cu、O2与稀H2SO4反应代替Cu与浓H2SO4反应制胆矾是“绿色化学”的体现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③②⑤⑥④ |
| B、③②④①⑦ |
| C、③②④⑤⑦ |
| D、②④①⑦⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.
设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
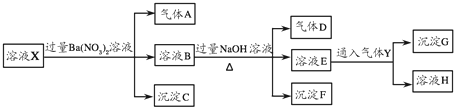
查看答案和解析>>
科目:高中化学 来源: 题型:
 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com