
(1)在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为________________________________________________________________________。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为____________________。
③25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______(填字母)。
a.用pH计测量0.1 mol ·L-1 NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
(2)①肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:_______ (写一步即可)。
②NH 在溶液中能发生水解反应。在25 ℃时,0.1 mol·L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol·L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=______。
在溶液中能发生水解反应。在25 ℃时,0.1 mol·L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol·L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=______。
答案 (1)①c(K+)>c(SCN-)>c(OH-)>c(H+)
②Na2CO3+HClO===NaHCO3+NaClO ③ac
(2)①N2H4+H2ON2H +OH-
+OH-
②1×10-5mol·L-1
解析 (1)①SCN-水解溶液显碱性;②由电离常数大小可知酸性强弱HSCN>H2CO3>HClO>HCO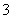 ,所以Na2CO3与过量HClO反应只能生成比HClO弱的HCO
,所以Na2CO3与过量HClO反应只能生成比HClO弱的HCO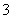 ;③b选项,HClO具有漂白性,不能用pH试纸测其pH,错误。(2)①依据氨水电离方程式NH3·H2ONH
;③b选项,HClO具有漂白性,不能用pH试纸测其pH,错误。(2)①依据氨水电离方程式NH3·H2ONH +OH-书写;②首先写出Kb(NH3·H2O)=
+OH-书写;②首先写出Kb(NH3·H2O)=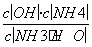 ,然后分析NH4Cl溶液中的c(H+)=水电离出的c(H+)=1×10-5mol·L-1,溶液中c(OH-)=1×10-9mol·L-1;依据NH
,然后分析NH4Cl溶液中的c(H+)=水电离出的c(H+)=1×10-5mol·L-1,溶液中c(OH-)=1×10-9mol·L-1;依据NH +H2ONH3·H2O+H+可知c(NH3·H2O)=c(H+)=1×10-5mol·L-1、c(NH
+H2ONH3·H2O+H+可知c(NH3·H2O)=c(H+)=1×10-5mol·L-1、c(NH )=0.1 mol·L-1-c(NH3·H2O)=0.1 mol·L-1-1×10-5mol·L-1≈0.1 mol·L-1,代入可得Kb(NH3·H2O)=1×10-5mol·L-1。
)=0.1 mol·L-1-c(NH3·H2O)=0.1 mol·L-1-1×10-5mol·L-1≈0.1 mol·L-1,代入可得Kb(NH3·H2O)=1×10-5mol·L-1。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1 min后,测得容器内A的浓度为x mol·L-1。这时B的浓度为______ mol·L-1,C的浓度为______ mol·L-1。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO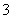 、CO
、CO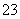 、ClO-结合H+的能力由强到弱的顺序为____________。
、ClO-结合H+的能力由强到弱的顺序为____________。
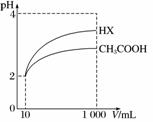
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,充电时,总反应为Na2Sx === 2Na + xS(3<x<5),其反应原理如图所示,下列说法错误的是( )
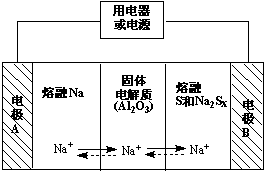
A.放电时,电极A为负极
B.该电池工作的适宜温度应控制10℃左右
C.放电时,内电路中Na+的移动方向为A到B
D.充电时,阳极的电极反应式为 Sx2- - 2e- === xS
查看答案和解析>>
科目:高中化学 来源: 题型:
重晶石矿的主要成分为硫酸钡,纯净的硫酸钡才能供医用作“钡餐”。硫化钡是可溶于水的盐。讨论用重晶石矿制硫酸钡,设计流程如下:

写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。为进行反应②先要分离出硫化钡,采用的方法是 。反应前要在溶液中滴入少量Ba(OH)2溶液,其作用是: 。
(2)若B物质在该生产过程中可循环使用,则反应③的化学方程式是: 。
(3)有人提出反应②产生了有臭鸡蛋气味的有毒气体,可采用改变反应物的方法避免产生该气体,则反应②的化学方程式是: 。此时若要B物质还能循环使用,则C为 (写化学式)。BaSO4是因为具有 、 等性质而可用作“钡餐”。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的性质呈现周期性变化的根本原因是( )
A.原子半径呈周期性变化
B.元素的化合价呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.第一电离能呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
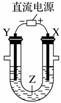 利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com