
300ml 0.01mol/L的FeCl3溶液与200mL 0.06mol/L的KCl溶液中,所含Cl﹣的物质的量浓度之比为()
A. 1:1 B. 1:2 C. 1:3 D. 3:2
考点: 物质的量浓度.
专题: 计算题.
分析: 物质的量浓度与溶液的体积无关,先根据溶液中氯离子的物质的量浓度=盐的浓度×化学式中氯离子个数,求出各溶液中Cl﹣的物质的量浓度,然后求比值.
解答: 解:300mL 0.01mol•L﹣1的FeCl3溶液中Cl﹣的物质的量浓度为0.01mol•L﹣1×3=0.03mol•L﹣1,200mL 0.06mol•L﹣1的KCl溶液中Cl﹣的物质的量浓度为0.06mol•L﹣1,Cl﹣的物质的量浓度之比为0.03:0.06=1:2,
故选B.
点评: 本题考查了溶液中氯离子物质的量浓度的计算,溶液中氯离子的物质的量浓度为盐的浓度与化学式中离子个数的积,与溶液的体积无关.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
描述CH3﹣CH=CH﹣C≡C﹣CF3分子结构的下列叙述中,正确的是( )
|
| A. | 6个碳原子有可能都在一条直线上 |
|
| B. | 6个碳原子有可能都在同一平面上 |
|
| C. | 6个碳原子不可能都在同一平面上 |
|
| D. | 最多有9个原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法错误的是()
A. 1molNH3中含有6.02×1024个电子
B. 1mol水中含有2mol氢和1mol氧
C. 1molOH﹣中含有8mol中子
D. 2.3g钠由原子变成离子时,失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 澄清石灰水与盐酸混合Ca(OH)2+2H+=Ca2++2H2O
B. 氢氧化铁与盐酸反应H++OH﹣=H2O
C. 氯化钡溶液与稀硫酸混合Ba2++SO42﹣=BaSO4↓
D. 铝与硝酸汞溶液反应Al+Hg2+=Al3++Hg
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应 8NH3+3Cl2=6NH4Cl+N2 回答下列问题:
(1)氧化剂是,还原剂NH3.
(2)氧化剂与氧化产物的质量比.
(3)当有68g NH3参加反应时,计算被氧化的物质的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的
是( )
A.0.1 mol·L-1NaOH溶液:K+、Na+、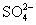 、
、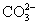
B.0.1 mol·L-1Na2CO3溶液:K+、Ba2+、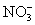 、Cl-
、Cl-
C.0.1 mol·L-1FeCl3溶液:K+、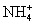 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)= 1×1014的溶液:Ca2+、Na+、ClO-、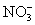
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )
|
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
|
| B. | 合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施 |
|
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
|
| D. | 对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com