
【题目】有机合成是制药工业中的重要手段。G是某抗炎症药物的中间体,其合成路线如图:
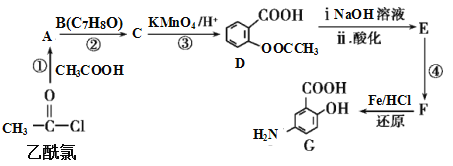
已知:
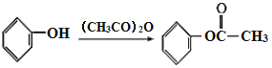 ,
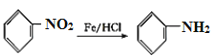
,
(1)B的结构简式为_____。
(2)反应④的条件为____;①的反应类型为___;反应②的作用是____。
(3)下列对有机物G的性质推测正确的是____(填选项字母)。
A.具有两性,既能与酸反应也能与碱反应
B.能发生消去反应、取代反应和氧化反应
C.能聚合成高分子化合物
D.1mol G与足量NaHCO3溶液反应放出2mol CO2
(4)D与足量的NaOH溶液反应的化学方程式为_____。
(5)符合下列条件的C的同分异构体有___种。
A.属于芳香族化合物,且含有两个甲基 B.能发生银镜反应 C.与FeCl3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的是___(写出其中一种的结构简式)。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位;苯环上有羧基时,新引入的取代基连在苯环的间位。根据题中的信息,写出以甲苯为原料合成有机物![]() 的流程图(无机试剂任选)。_______
的流程图(无机试剂任选)。_______
合成路线流程图示例如图:X![]() Y
Y![]() Z…目标产物
Z…目标产物
【答案】![]() 浓硫酸、浓硝酸、加热 取代反应 保护酚羟基,以防被氧化 AC
浓硫酸、浓硝酸、加热 取代反应 保护酚羟基,以防被氧化 AC 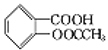 +3NaOH
+3NaOH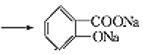 +CH3COONa+2H2O 16
+CH3COONa+2H2O 16 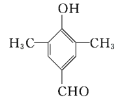 或
或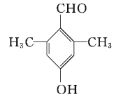
【解析】
根据D的结构简式(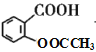 ),可知C分子中含有苯环,苯环上有两个邻位取代基,其中一个为-OOCCH3,另一个为烃基,被酸性高锰酸钾氧化为羧基生成D,B分子中有苯环,结合已知的第一个反应:
),可知C分子中含有苯环,苯环上有两个邻位取代基,其中一个为-OOCCH3,另一个为烃基,被酸性高锰酸钾氧化为羧基生成D,B分子中有苯环,结合已知的第一个反应: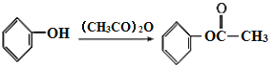 ,可知B分子中也有在苯环上处于邻位的两个取代基,其中一个是羟基,另一个是甲基,所以A是乙酸酐,由乙酰氯和乙酸发生取代反应生成。D在NaOH溶液中水解然后再酸化,得到的E为
,可知B分子中也有在苯环上处于邻位的两个取代基,其中一个是羟基,另一个是甲基,所以A是乙酸酐,由乙酰氯和乙酸发生取代反应生成。D在NaOH溶液中水解然后再酸化,得到的E为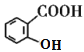 ,比较E和G的结构,再结合已知:
,比较E和G的结构,再结合已知: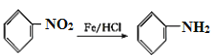 可知,E到F是发生了硝化反应,E中苯环羟基的对位碳原子上的氢原子被硝基取代生成了F,F到G是硝基被还原为氨基。
可知,E到F是发生了硝化反应,E中苯环羟基的对位碳原子上的氢原子被硝基取代生成了F,F到G是硝基被还原为氨基。
(1)从上面的分析可知,B的结构简式为![]() ;
;
(2)反应④是硝化反应,需要浓硝酸作反应物,浓硫酸作催化剂,而且反应还需加热;①是取代反应,反应②的作用是保护酚羟基,以防被高锰酸钾氧化。故答案为:浓硫酸、浓硝酸、加热;取代反应;保护酚羟基,以防被氧化;
(3)G的结构简式为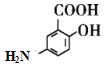 ;
;
A.G中有羧基,显酸性,还有氨基,显碱性,所以G具有两性,既能与酸反应也能与碱反应,故A正确;
B.醇可以发生消去反应,但酚不能发生消去反应,酚和羧酸都可以发生取代反应,酚羟基有还原性,可以被氧化,发生氧化反应,故B错误;
C.在G的分子中既有羧基,又有羟基,可以发生缩聚反应,生成聚酯,故C正确;
D.能和NaHCO3溶液反应放出CO2的只能是羧基,而1mol羧基只能生成1mol CO2,故1molG与足量NaHCO3溶液反应放出1molCO2,故D错误;
故选AC;
(4)D的结构简式为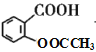 ,与足量的NaOH溶液反应时,羧基可以和NaOH发生酸碱中和,酯基可以发生水解,水解后生成的不是醇,而是酚,会继续和NaOH发生中和反应,所以1mol D能消耗3mol NaOH,发生反应的化学方程式为
,与足量的NaOH溶液反应时,羧基可以和NaOH发生酸碱中和,酯基可以发生水解,水解后生成的不是醇,而是酚,会继续和NaOH发生中和反应,所以1mol D能消耗3mol NaOH,发生反应的化学方程式为 +3NaOH
+3NaOH +CH3COONa+2H2O;
+CH3COONa+2H2O;
(5)C为![]() ,C的同分异构体属于芳香族化合物,即含有苯环,与FeCl3溶液发生显色反应,苯环上直接连有羟基;能发生银镜反应,要求分子中有醛基。C的苯环上共有3个碳原子和2个氧原子,酚羟基和醛基各用了1个氧原子,醛基还用了1个碳原子,还有2个碳原子,根据含有两个甲基的要求,苯环上共有4个取代基,两个甲基,一个酚羟基和一个醛基;可以先固定两个甲基的位置,有邻、间、对三种位置,然后再连上酚羟基和醛基。当2个甲基处于邻位时,酚羟基和醛基有6种不同的位置,当2个甲基处于间位时,酚羟基和醛基有7种不同的位置,当2个甲基处于对位时,酚羟基和醛基有3种不同的位置,所以共有16种同分异构体。其中核磁共振氢谱有/span>4组峰,且峰面积之比为6∶2∶1∶1的是
,C的同分异构体属于芳香族化合物,即含有苯环,与FeCl3溶液发生显色反应,苯环上直接连有羟基;能发生银镜反应,要求分子中有醛基。C的苯环上共有3个碳原子和2个氧原子,酚羟基和醛基各用了1个氧原子,醛基还用了1个碳原子,还有2个碳原子,根据含有两个甲基的要求,苯环上共有4个取代基,两个甲基,一个酚羟基和一个醛基;可以先固定两个甲基的位置,有邻、间、对三种位置,然后再连上酚羟基和醛基。当2个甲基处于邻位时,酚羟基和醛基有6种不同的位置,当2个甲基处于间位时,酚羟基和醛基有7种不同的位置,当2个甲基处于对位时,酚羟基和醛基有3种不同的位置,所以共有16种同分异构体。其中核磁共振氢谱有/span>4组峰,且峰面积之比为6∶2∶1∶1的是 或
或 。故答案为16,
。故答案为16, 或
或 ;
;
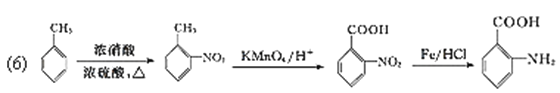
(6)以甲苯为原料合成![]() ,需要在苯环上连上羧基和氨基,羧基可以通过甲基被氧化得到,氨基可以先在苯环上连上硝基,然后再还原得到。因为苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位;苯环上有羧基时,新引入的取代基连在苯环的间位。最终合成的有机物
,需要在苯环上连上羧基和氨基,羧基可以通过甲基被氧化得到,氨基可以先在苯环上连上硝基,然后再还原得到。因为苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位;苯环上有羧基时,新引入的取代基连在苯环的间位。最终合成的有机物![]() 的两个取代基在邻位,所以甲苯应先硝化,在甲基的邻位引入硝基,然后再氧化甲基成为羧基,最后还原硝基为氨基;流程为:
的两个取代基在邻位,所以甲苯应先硝化,在甲基的邻位引入硝基,然后再氧化甲基成为羧基,最后还原硝基为氨基;流程为: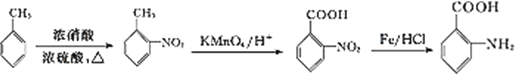 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】醋酸铜[(CH3COO)2Cu·H2O](其相对式量为200)常用作分析化学的分析试剂,还用作有机合成催化剂、瓷釉颜料等。可以用碱式碳酸铜与醋酸作用来制备。
实验步骤:
(I)碱式碳酸铜的制备

(Ⅱ)醋酸铜的制备
碱式碳酸铜与醋酸反应制得醋酸铜:
Cu(OH)2·CuCO3+4CH3COOH=2(CH3COO)2Cu·H2O+CO2↑+H2O
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量醋酸至固体不再溶解,趁热过滤。滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
回答下列问题:
(1)步骤(ⅰ)将研磨后混合物注入热水中反应,写出离子反应方程式______。
(2)碱式碳酸铜的制备需在热水中进行反应,且温度需控制在60℃左右,请解释原因______。
(3)在步骤(ⅰ)与步骤(ⅱ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤、趁热过滤与减压过滤,下列装置中没有使用到的有______。
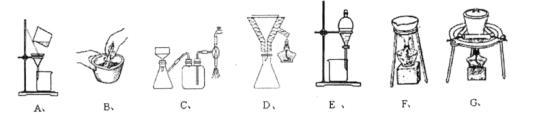
(4)步骤ⅱ中洗涤晶体的具体操作是______。
(5)最终称量所得的产品为8.0g,则产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) ![]() 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
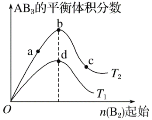
A. 若T2<T1,则正反应一定是放热反应
B. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
C. 达到平衡时A2的转化率大小为b>a>c
D. 若T2<T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室可以用KMnO4制备氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
①该反应的氧化剂是____,氧化产物是_____,还原产物是____。
②当有15.8gKMnO4参加反应时,被氧化的HCl有___mol,标况下生成Cl2的体积为____L,有____mol电子转移。
(2)A的核电荷数为n,A2+和B3-的电子层结构相同,则B原子的质子数是__。
(3)在1H216O、2H217O、2H218O、1H35Cl、1H37Cl中,共存在__种原子,_种元素。
(4)将K(Al2Si3O9)(OH)改写为氧化物形式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是 ( )
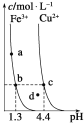
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kpa时,乙烷和乙炔组成的混合烃20mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了42mL,原混合烃中乙炔的体积分数为( )
A. 25%B. 40%C. 60%D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B两种有机物可以互溶,有关性质如下:
物质 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
(1)要除去A和B的混合物中的少量B,可采用的_______________方法可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
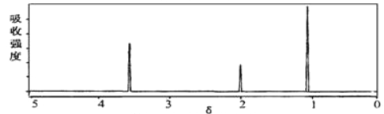
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应且消耗6.72L(标准状况)氧气,生成5.4gH2O和8.8gCO2,则该物质的实验式是__________;质谱图显示,A的相对分子质量为46,又已知有机物A的核磁共振氢谱如图所示,则A的结构简式为________________。
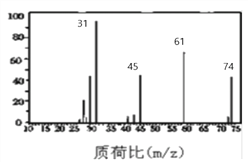
(3)下图是B的质谱图,则其相对分子质量为 ________ ,
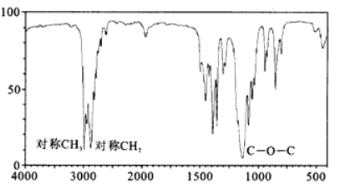
(4)B的红外光谱如图所示,则B的结构简式为__________________________。
(5)准确称取一定质量的A和B的混合物,在足量氧气充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增加14.4g和26.4g。计算混合物中A和B的物质的量之比_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 | 450 | 500 | 550 | 600 |
SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断△H________0(填“>”、“=”或“<”)。
(2)能判断该反应是否达到平衡状态的是___________。
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F. V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为____。
②此时的温度为____℃。
③此温度下的平衡常数为_____(可用分数表示)。
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将_________向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com