
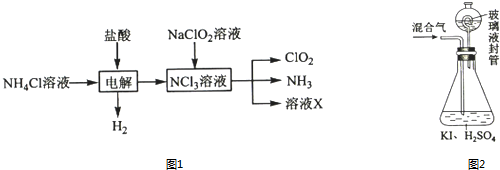
分析 (1)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O;
(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-,
①由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
②在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-;
③由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②玻璃液封装置可防止有害气体逸出;
③淀粉遇碘单质变蓝;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
(4)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子.
解答 解:(1)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,
故答案为:2:1;
(2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,
故答案为:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
②在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,发生NCl3+NaClO2+H2O→ClO2+NH3+NaOH+NaCl,溶液X中大量存在的阴离子有Cl-、OH-,
故答案为:Cl-、OH-;
③a.ClO2易溶于水,不能利用水吸收氨,故a错误;
b.碱石灰不能吸收氨气,故b错误;
c.浓硫酸可以吸收氨气,且不影响ClO2,故c正确;
d.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故d错误;
故答案为:c;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
②玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出),
故答案为:吸收残留的ClO2气体(避免碘的逸出);
③V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,
故答案为:淀粉;溶液由蓝色变为无色,且半分钟内不变色;
④含有Na2S2O3物质的量为0.02 L×0.1mol/L=0.002 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,所以m(ClO2)=0.004 mol×67.5g/mol=0.02700g,
故答案为:0.02700.
(4)若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,
故答案为:d.
点评 本题考查物质含量的测定,为高频考点,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com