
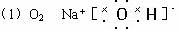
请填空:
(1)写出I的分子式______________,D的电子式________________。?
(2)写出X与D溶液反应的离子方程式___________________________。?
(3)写出电解C溶液的化学方程式_______________________________。
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:阅读理解
(13分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
(1)甲组同学设计下图装置来证实稀硝酸与铜反应,步骤如下。
A、检验50ml针筒的气密性。
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后 。
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住。
回答以下相关问题:
①B中应补充的操作是 。
②一段时间后在针筒内观察到溶液颜色为蓝色,有 色气体产生。该反应的离子方程式为 。
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是 。
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)__________,原因是 。(结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确, 三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生。认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议。请分析原因 。
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色。请用方程式表示溶液颜色变化的反应原理__________ ____________。
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色。
③从环保的角度看,你认为三个方案中最好的是哪一个 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省杭州地区七校高一下学期期中联考化学试卷(带解析) 题型:实验题
(13分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
(1)甲组同学设计下图装置来证实稀硝酸与铜反应,步骤如下。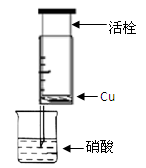
A、检验50ml针筒的气密性。
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后 。
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住。
回答以下相关问题:
①B中应补充的操作是 。
②一段时间后在针筒内观察到溶液颜色为蓝色,有 色气体产生。该反应的离子方程式为 。
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是 。
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省沈阳市高二上教学质量监测化学试卷(解析版) 题型:填空题
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)

(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系

①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为 。(混合后溶液体积的变化忽略不计)
查看答案和解析>>
科目:高中化学 来源:2014届浙江省杭州地区七校高一下学期期中联考化学试卷(解析版) 题型:实验题
(13分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
(1)甲组同学设计下图装置来证实稀硝酸与铜反应,步骤如下。

A、检验50ml针筒的气密性。
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后 。
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住。
回答以下相关问题:
①B中应补充的操作是 。
②一段时间后在针筒内观察到溶液颜色为蓝色,有 色气体产生。该反应的离子方程式为 。
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是 。
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
|
组 |
m(Cu)/g |
硝酸(过量) |
溶液颜色 |
|
A |
1 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
|
|
B |
0.5 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
|
|
C |
2 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)__________,原因是 。(结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确, 三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生。认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议。请分析原因 。
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色。请用方程式表示溶液颜色变化的反应原理__________ ____________。
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色。
③从环保的角度看,你认为三个方案中最好的是哪一个 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com