
分析 (1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子或碱中氢氧根离子浓度相等时,其抑制水电离程度相等;
(2)一水合氨是弱电解质,pH=12的氨水浓度大于0.01mol/L,所以②的浓度小于③,混合后恰好完全反应,则酸的体积大于氨水;
(3)将溶液②pH=12的氨水和④pH=12的NaOH溶液同等稀释10倍后,一水合氨溶液中一水合氨存在电离平衡,稀释促进电离;
(4)①0.01mol/L CH3COOH溶液 和 ④pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,混合后溶液中存在电荷守恒分析;
解答 解:(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离,①②③④⑥抑制水电离,⑤既不促进水电离也不抑制水电离,所以水的电离程度最大的是⑤;
酸中氢离子浓度和碱中氢氧根离子浓度相等时,水的电离程度相同,③中氢离子浓度和②④中氢氧根离子浓度相等,所以水的电离程度相同的是②③④;
故答案为:⑤;②③④;
(2)一水合氨是弱电解质,pH=12的氨水浓度大于0.01mol/L,所以③的浓度小于②,混合后恰好完全反应,则酸的物质的量等于氨水的物质的量,因为酸的浓度小于氨水,所以酸的体积大于氨水,故答案为:>;
(3)将溶液②pH=12的氨水和④pH=12的NaOH溶液总氢氧根离子浓度相同,同等稀释10倍后,一水合氨溶液中一水合氨存在电离平衡又电离出氢氧根离子,溶液中氢氧根离子浓度大于氢氧化钠溶液,溶液PH②>④,故答案为:>;
(4)①0.01mol/L CH3COOH溶液 和 ④pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,混合后溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),若有c(CH3COO-)>c(H+),c(Na+)<c(OH-),溶液酸碱性不能确定,故选D,
故选D.
点评 本题考查了弱电解质的电离及pH简单计算,根据弱电解质电离特点判断相同pH的溶液中物质的量浓度关系,题目难度中等.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
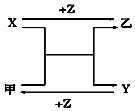 X、Y、Z是三种常见的单质,甲、乙是常见化合物,有如图转化关系(未注明反应条件),下列说法不正确是( )
X、Y、Z是三种常见的单质,甲、乙是常见化合物,有如图转化关系(未注明反应条件),下列说法不正确是( )| A. | 若X、Y均为金属单质,则甲不可能为黑色固体 | |
| B. | 若X为金属单质,Y为非金属固体单质,则Z为O2 | |
| C. | 若X为金属单质,Y为非金属气体单质,则乙可能为黑色固体 | |
| D. | 若X、Y均为非金属固体单质,则Z可能为O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| B. | 银质奖牌久置后表面变暗 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由Al电极通过外电路流向Ag2O/Ag电极 | |
| B. | 电池负极附近溶液pH升高 | |
| C. | 正极反应式为:Ag2O+2e-+H2O=2Ag+2OH- | |
| D. | 负极会发生副反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 新制氯水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com