
| A、NaCl溶液、CO2 |
| B、铜、蔗糖 |
| C、液态HCl、NH3 |
| D、汽油、硫酸溶液 |


科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:丙<丁<戊 |
| B、金属性:甲<丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰乳与盐酸溶液反应 |
| B、氢氧化铁与硫酸反应 |
| C、氢氧化钡溶液与硫酸反应 |
| D、氢氧化钠溶液与硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2既是氧化剂,又是还原剂 |
| B、NH4Cl中的氮元素被还原 |
| C、被氧化的氮原子与被还原的氮原子之比为1:1 |
| D、每生成1mol N2时,转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、②⑤ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 仪器或用品 |
| A | 测定新制氯水中的pH | pH试纸、玻璃棒、表面皿 |
| B | 鉴别开AlCl3和NaOH两种溶液 | 试管、滴管 |
| C | 分离乙酸和乙酸乙脂 | 分液漏斗、烧杯、玻璃棒 |
| D | 用Na2CO3固体配制500mL 1.0mol?L-1的Na2CO3溶液 | 天平、量筒、500mL烧杯、玻璃棒 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
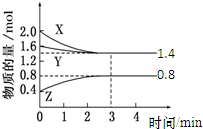 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.2 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3X(g)+Y(g)?2Z(g) |
| C、保持其他条件不变,增大压强,平衡向正反应方向移动 |
| D、温度不变,增大X的浓度,该反应的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| W | Y | R | |
| Z | |||
| A、常温常压下,五种元素对应的单质中有两种是气态 |
| B、Y元素最高价氧化物对应水化物的酸性比W元素的弱 |
| C、Y、Z的阴离子电子层结构都与R原子的相同 |
| D、W的氢化物比X的氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
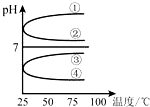 Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,
Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,| c(B) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| 温度/℃ | 25 | T1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com