
| A. | 整个过程中,H20的电离度逐渐增大 | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(0H-) | ||
| C. | c(Na+)+c(H+)═c(0H-)+c(HS-)+2c(S2-) | D. | c(Na+)═c(HS-)+c(H2S) |
分析 n(H2S)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=1mol/L×0.1L=0.1mol,二者恰好反应生成1mol/LNaHS,溶液中c(H2S)>c(S2-),说明HS-水解程度大于电离程度,但程度都较小,
A.酸或碱抑制水电离,含有弱离子的盐促进水电离;
B.溶液中c(H2S)>c(S2-),说明HS-水解程度大于电离程度,但程度都较小,溶液呈碱性;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:n(H2S)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=1mol/L×0.1L=0.1mol,二者恰好反应生成1mol/LNaHS,溶液中c(H2S)>c(S2-),说明HS-水解程度大于电离程度,但程度都较小,
A.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以NaOH抑制水电离、NaHS促进水电离,Na2S水解程度大于NaHS,所以水的电离程度先增大后减小,故A错误;
B.溶液中c(H2S)>c(S2-),说明HS-水解程度大于电离程度,但程度都较小,溶液呈碱性,所以c(H+)<c(0H-),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(0H-)+c(HS-)+2c(S2-),故C正确;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)═c(HS-)+c(H2S)+c(S2-),故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,正确判断溶液中溶质是解本题关键,注意反应过程先生成Na2S后生成NaHS,注意物料守恒、电荷守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- | |
| B. | 某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水 | |
| C. | 向某白色固体粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原固体粉末中一定含CO32-或HCO3- | |
| D. | 将某白色固体粉末与氢氧化钠浓溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,证明原固体中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b端是直流电源的负极 | |
| B. | 实验过程中溶液的导电能力没有明显变化 | |
| C. | 通电一段时间后,在阴极附近观察到黄绿色气体 | |
| D. | 若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa混合液,溶液显酸性,则溶液中粒子浓度:c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-) | |
| B. | 浓度均为0.1 mol•L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)═2c(H+)+c(HA) | |
| D. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)═c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稀释前,c (A)>10 c (B) | |
| B. | 稀释前,A溶液中水电离出的OH- 浓度是B溶液中由水电离出的OH- 浓度的10倍 | |
| C. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| D. | M点时A和B的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
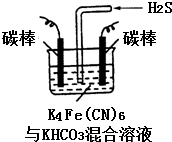 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
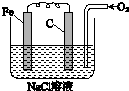 金属腐蚀的电化学原理可用如图模拟.
金属腐蚀的电化学原理可用如图模拟.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com