
| 9.2g |
| 92g/mol |
| 7.2g |
| 18g/mol |
| 13.2g |
| 44g/mol |
| 92-12×3-8 |
| 16 |


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
| A、水的离子积仅适用于纯水 |
| B、水的电离和电解都需要电 |
| C、升高温度一定使水的离子积增大 |
| D、加入电解质一定会破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应中,发生物质变化的同时不一定发生能量变化 |
| B、△H>O表示放热反应,△H<0表不吸热反应 |
| C、△H的大小与反应物的用量无关 |
| D、生成物的总能量小于反应物的总能量时,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
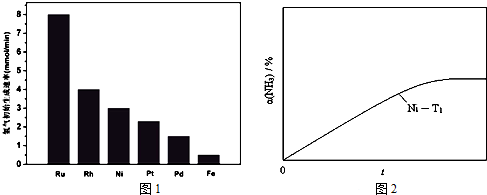
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8 kJ?mol-1,则H2燃烧热为-241.8 kJ?mol-1 |
| B、已知:S(g)+O2(g)=SO2(g)△H1=-Q1;S(s)+O2(g)=SO2(g)△H2=-Q2(Q1、Q2均正值),则Q1<Q2 |
| C、吸热反应一需要加热才能发生 |
| D、反应物总能量大于生成物总能量是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、以此电池为电源精炼铜,当有0.1mole-转移时,有3.2g铜溶解 |
| B、若以甲烷为燃料气时负极反应式:CH4+5O2--8e-=CO32-+2H2O |
| C、C、该电池使用过程中需补充Li2CO3和K2CO3 |
| D、空气极发生电极反应式为:O 2+4e-+2CO 2=2CO 32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向20mL 0.2mol?L-1H2A溶液中滴加 0.2mol?L-1NaOH溶液.有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).请根据图示填空:
常温下,向20mL 0.2mol?L-1H2A溶液中滴加 0.2mol?L-1NaOH溶液.有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).请根据图示填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(H2SO3)+c(HSO3-)+c (H+) |
| B、c(SO32-)+c(OH-)=c(H+)+c(H2SO3) |
| C、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com