
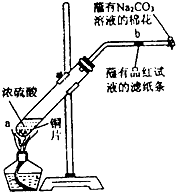
 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:分析 (1)铜和浓硫酸在加热条件下能发生反应,生成硫酸铜和二氧化硫、水;
(2)二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,加热时会恢复原来的颜色;
(3)上层是硫酸,下层是生成的硫酸铜,溶于水显蓝色;
(4)二氧化硫有毒,所以不能直接排空,碳酸钠水解使得溶液呈碱性,可以吸收二氧化硫气体;
(5)由于在反应过程中,硫酸的浓度是逐渐降低的,而稀硫酸和铜不反应,则实际上浓硫酸的体积应该稍大.
解答 解:(1)浓硫酸具有强氧化性,能和铜反应,被铜还原为二氧化硫,所以产物有生成的硫酸铜、二氧化硫和水;书写化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫能和有色物质生成无色物质,二氧化硫能使品红溶液褪色,所以二氧化硫具有漂白性;但生成的无色物质不稳定,加热时会恢复原来的颜色.
故答案为:品红褪色;恢复红色;
(3)铜和浓硫酸在加热条件下能发生反应,生成硫酸铜,上层是硫酸,下层是生成的硫酸铜,溶于水显蓝色,
故答案为:蓝;
(4)SO2是大气污染物,并能随意排放,则玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是吸收二氧化硫,防止污染,有关的方程式是:Na2CO3+SO2=Na2SO3+CO2,
故答案为:吸收二氧化硫,防止污染;
(5)铜和热的浓硫酸反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,当被还原的硫酸为0.9mol,理论上需18mol/L的浓硫酸的体积为100mL,但铜和稀硫酸不反应,
故答案为:大于.
点评 本题考查性质方案的设计,涉及铜和浓硫酸的反应、SO2性质的检验以及尾气处理和有关氧化还原反应的计算,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
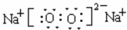 ,ED4的电子式是
,ED4的电子式是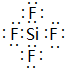 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA | |
| B. | 0.1mol${\;}_{35}^{81}$Br原子中含中子数为3.5NA | |
| C. | 6.0g SiO2晶体中含有的硅氧键数目为0.4NA | |
| D. | 7.8g过氧化钠中所含有的阴离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
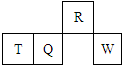 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | W对应的单质只可以跟强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.Omol•L-1 | B. | 2.Omol•L-1 | C. | O.3mol•L-1 | D. | O.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度 实验次数 | 起始温度t1/℃ | 终止温度t℃/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com