
| A. | 氢能将是二十一世纪的重要能源,推广应用氢能最关键技术是高容量储氢材料的研制 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,由此可推测TiO2光触媒技术制成的“木地板精油可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路 |
分析 A.氢气属于清洁能源且是二十一世纪的重要能源,但因为是气体难以储存和运输,要推广应用氢能源,必须首先要研制高容量储氢材料;
B.活性氧具有强氧化性,能氧化甲醛、苯、氨等;
C.二氧化硅和强酸不反应;
D.根据元素在周期表中的位置,结合元素周期律的相似性和递变性,可推知元素可能具有的性质.
解答 解:A.氢气属于清洁能源且是二十一世纪的重要能源,但因为是气体难以储存和运输,必须首先要研制高容量储氢材料,才能推广和应用氢能源,所以推广应用氢能最关键技术是高容量储氢材料的研制,故A正确;
B.纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,活性氧具有强氧化性,能氧化甲醛、苯、氨等,所以可以有效降解甲醛、苯、氨等居室污染物,故B正确;
C.二氧化硅与强酸不反应,二氧化硅能与强碱反应,所以光导纤维遇强碱都会“断路”,故C错误;
D.元素周期表中,不同位置的元素具有不同的性质和用途,周期表中位置靠近的元素性质相似,这就启发人们在周期表中一定的区域内寻找新的物质,所以门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路,故D正确;
故选C.
点评 本题考查较综合,涉及元素化合物性质、元素周期表作用等知识点,为高频考点,明确元素周期表制作根据、元素化合物性质是解本题关键,注意二氧化硅性质特殊性,二氧化硅和一般的强酸不反应但HF反应,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
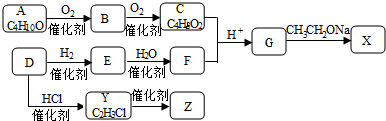
 ;
; ,反应类型是取代反应;
,反应类型是取代反应;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数=A-n | B. | 中子数=A-Z | C. | 电子数=Z+n | D. | 所带电荷数=n |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
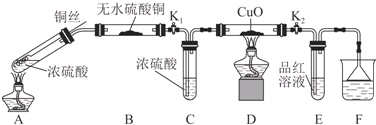
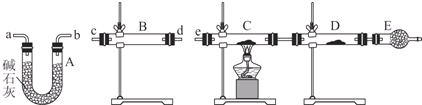
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
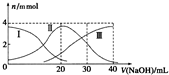 常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )| A. | H2A在水中电离方程式为:H2A?2H++A2- | |
| B. | V(NaOH)=20ml时,溶液呈酸性 | |
| C. | V(NaOH)=30mL时,溶液中有以下关系:c(A2-)+c(H2A)+c(HA-)=c(Na+) | |
| D. | V(NaOH)=40mL时,溶液中有以下关系:c(H+)+c(HA-)+c(H2A)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com