
| A. | 酸式滴定管用水洗净后未用标准液润洗 | |
| B. | 锥形瓶内有水珠未干燥就加入待测的氢氧化钠溶液 | |
| C. | 滴定终点时俯视滴定管读数 | |
| D. | 滴定时溶液刚变成无色就立即停止滴定 |
分析 用已知物质的量浓度的盐酸滴定待测的氢氧化钠溶液,则c(NaOH)=$\frac{c(盐酸)V(盐酸)}{V(NaOH)}$,不当操作导致V(盐酸)偏大,会使滴定结果偏高,以此来解答.
解答 解:A.酸式滴定管用水洗净后未用标准液润洗,消耗V(盐酸)偏大,会使滴定结果偏高,故A选;
B.锥形瓶内有水珠未干燥就加入待测的氢氧化钠溶液,n(NaOH)不变,则对实验无影响,故B不选;
C.滴定终点时俯视滴定管读数,V(盐酸)偏小,则会使滴定结果偏低,故C不选;
D.滴定时溶液刚变成无色就立即停止滴定,没有等到30s内不恢复,V(盐酸)偏小,则会使滴定结果偏低,故D不选;
故选A.
点评 本题考查中和滴定,为高频考点,把握滴定原理、仪器的使用、实验操作为解答的关键,侧重分析与实验能力的考查,注意结合计算式及不当操作分析误差,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 通入稀有气体使压强增大,平衡不移动 | |
| B. | 增大压强同时又升高温度,反应速率加快且可以提高Z 的产率 | |
| C. | 降低温度,混合气体的平均相对分子质量变大 | |
| D. | 增加X的物质的量,Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能确定 | B. | 为40mL | C. | 为10mL | D. | 大于为40mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
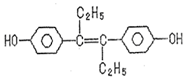
| A. | 可与NaOH和NaHCO3发生反应 | |
| B. | 可以用有机溶剂萃取 | |
| C. | 1mol该有机物可以与5molBr2发生反应 | |
| D. | 该有机物分子中,可能有18个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AX | B. | BX | C. | AY | D. | BY |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 2mol•L-1 KClO3溶液 | B. | 75mL 2mol•L-1CaCl2溶液 | ||
| C. | 150mL 2mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.09 | 0.08 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com