
| A. | SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 等物质的量的SO2和Cl2相遇在溶液中具有漂白能力 |
分析 A.依据二氧化硫漂白性与还原性解答;
B.具有漂白性的物质能使品红溶液褪色;
C.二氧化硫使红墨水褪色体现二氧化硫漂白性、活性炭能使红墨水褪色体现吸附性、漂白粉和过氧化钠使红墨水褪色体现强氧化性;
D.等物质的量的氯气与二氧化硫在水中反应生成盐酸和硫酸.
解答 解:A.SO2具有漂白性,能使品红溶液褪色,二氧化硫具有还原性,能够使溴水、KMnO4(H+),二氧化硫不能漂白指示剂,故A错误;
B.能使品红溶液褪色的不一定是SO2,可以是氯水,故B正确;
C.二氧化硫使红墨水褪色体现二氧化硫漂白性、活性炭能使红墨水褪色体现吸附性、漂白粉和过氧化钠使红墨水褪色体现强氧化性,所以其原理不同,故C错误;
D.等物质的量的氯气与二氧化硫在水中反应生成盐酸和硫酸,盐酸和硫酸都不具有漂白性,故D错误;
故选:B.
点评 本题考查物质的漂白性,侧重考查基本原理,明确常见漂白剂的漂白原理,熟悉二氧化硫具有漂白性、还原性是解题关键,题目难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 当a=b时,发生的离子总反应为:2OH-+CO2+Ba2+═BaCO3↓+H2O | |
| B. | 当3a=2b时,发生的离子总反应为:6OH-+3CO2+2Ba2+═2BaCO3↓+3H2O+CO32- | |
| C. | 当$\frac{3}{2}$a<b<3a时,溶液中含有n(CO32-):n(HCO3-)=(3a-b):(2b-3a) | |
| D. | 当3a=b时,溶液中Na+、Ba2+与HCO3-的物质的量之比为1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 50℃时,NH4Cl和HCl的混合液中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L的CH3COONa:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 某FeCl3溶液pH=4:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) | |
| D. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)═c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
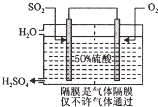 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸、纯碱、明矾、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | 电解质是在水溶液或熔融状态下能导电的化合物 | |
| C. | 在含有1 mol Fe(OH)3的胶体中,含有NA个Fe(OH)3胶粒 | |
| D. | 玻璃棒在化学实验中只起到搅拌的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 | |
| B. | 卤化氢的稳定性按HF、HCl、HBr、HI的顺序依次增大 | |
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 | |
| D. | 卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com