
| A. | 通入甲烷的一极为正极,该极c(OH-)减小 | |
| B. | 通入甲烷的一极的电极反应为CH4-8e-+3H2O=CO32-+10H+ | |
| C. | 通入氧气一极发生还原反应,电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该电池工作时,溶液中的阴离子向正极移动 |
分析 燃料原电池中,甲烷失电子发生氧化反应,所以通入燃料的电极为负极,电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,通入氧化剂的电极为正极,其电极反应是:O2+2H2O+4e-═4OH-,溶液中阴离子流向负极,阳离子流向正极.
解答 解:A.燃料原电池中,甲烷失电子发生氧化反应,所以通入燃料的电极为负极,故A错误;
B.碱性条件下,甲烷被氧化生成碳酸根离子,电极反应式是:CH4+10OH--8e-═CO32-+7H2O,故B错误;
C.碱性条件下,氧气得电子生成氢氧根离子,电极方程式为O2+2H2O+4e-=4OH-,故C正确;
D.放电时,溶液中阴离子流向负极,阳离子流向正极,故D错误.
故选C.
点评 本题考查碱性甲烷电池的工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意归纳电子、电流、离子的流向.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 酒精溶于水 | B. | HCl溶于水得盐酸 | ||
| C. | 将Na2SO4熔融呈液态 | D. | 从NH4HCO3中闻到了刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2吸收SO2的反应:MnO2+SO2═MnSO4 | |
| B. | MnO2作为碱性电池正极材料时的放电反应:MnO2+e-+H+═MnOOH | |
| C. | MnSO4与KMnO4反应制备MnO2:2MnO4-+3Mn2++2H2O═5MnO2+4H+ | |
| D. | 尾气中的SO2 还可用足量的氨水吸收:SO2+2NH3•H2O═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②③④⑥ | C. | ③④⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O很稳定,是因为水分子之间存在氢键 | |
| B. | HF的熔、沸点在同族元素的氢化物中出现反常,是因为HF分子中有氢键 | |
| C. | 卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大 | |
| D. | 氨气极易溶于水,与氢键没有关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
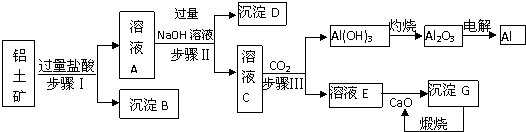
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烃能使溴水褪色 | B. | 该烃有三种不同的物质 | ||
| C. | 该烃的一氯取代物4种 | D. | 该烃的二氯取代物6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 干冰和氯化铵变成气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com