
| A. | 14C和l2C互称为同位素 | B. | 苯和环乙烷互称为同分异构体 | ||
| C. | 丁烷与戊烷互称为同系物 | D. | 金刚石和石墨称为同素异形体 |
分析 A.质子数相同,中子数不同的原子,互称为同位素;
B.分子式相同,结构不同的化合物,互为同分异构体;
C.结构相似,分子组成上相差一个CH2,均属于烷烃,互称为同系物;
D.同种元素形成的不同单质,互为同素异形体.
解答 解:A.126C和146C属于碳元素的两种不同核素,互称为同位素,故A正确;
B.苯的分子式为C6H6,环乙烷的分子式为C6H12,二者分子式不同,不是同分异构体,故B错误;
C.丁烷与戊烷结构相似,分子组成上相差一个CH2,均属于烷烃,互称为同系物,故C正确;
D.金刚石和石墨是碳元素的两单质,互为同素异形体,故D正确;
故选:B.
点评 本题考查同位素、同分异构体、同系物、同素异形体等,明确“四同”概念是解答本题的关键,题目难度不大,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 由溴丙烷水解制丙醇,由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯,由甲苯氧化制苯甲酸 | |
| C. | 由乙醛制乙醇,由乙醛制乙酸 | |
| D. | 由乙酸和乙醇制乙酸乙酯,由苯甲酸乙酯水解制苯甲酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KI+Br2═2KBr+I2 | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | NaH+H2O═NaOH+H2↑ | D. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知有机物X、M、A,B、C、D有如图所示的转化关系.X是天然的有机高分子化合物,C是食醋的主要成分.
已知有机物X、M、A,B、C、D有如图所示的转化关系.X是天然的有机高分子化合物,C是食醋的主要成分.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+HBr$\stackrel{加热}{→}$CH3CH2Br+H2O | |
| B. | C4H10$\stackrel{一定条件}{→}$C2H4+C2H6 | |
| C. | CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2↑+H2O | |
| D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 元素的相关信息 |
| A | A元素存在多种同素异形体,其中一种常用电极导电材料 |
| B | 短同期中金属性最强 |
| C | 单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
| E | 地壳中含量最多的金属 |
 ,含有的化学键类型为共价键;
,含有的化学键类型为共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2 | B. | Al | C. | Mn | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
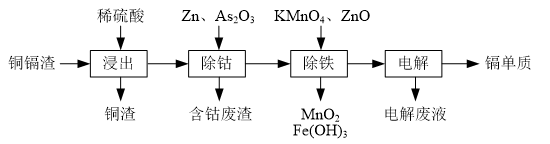
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com