考点:氧化还原反应方程式的配平,溶液的配制,中和滴定
专题:实验题,氧化还原反应专题
分析:(1)根据氧化还原反应中得失电子相等来配平方程式,1mol高锰酸根离子参加氧化还原反应得到5mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子;
(2)KMnO
4溶液能够腐蚀橡胶,应该用酸式滴定管;滴定完成时NaHSO
3溶液没有剩余,溶液会呈高锰酸钾溶液的颜色,且半分钟内颜色不褪去,就说明NaHSO
3溶液已完全被氧化;
(3)根据c=
判断不当操作对n或V的影响判断测定结果,
A、酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大;
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对实验无影响;
C、定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大;
D、观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小;
(4)实验2中KMnO
4溶液的体积的偏离较大,舍去不用,由实验1和3取KMnO
4溶液体积的平均值;
根据高锰酸钾和亚硫酸氢钠之间的关系式计算亚硫酸氢钠的物质的量浓度.
解答:
解:(1)1mol高锰酸根离子参加氧化还原反应得到5mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是10,则高锰酸根离子的计量数是2,亚硫酸氢根离子的计量数是5,其它原子根据原子守恒来配平,所以该方程式为:2MnO
4-+5HSO
3-+H
+=2Mn
2++5SO
42-+3H
2O;
故答案为:2,5,1,2,5,3;
(2)KMnO
4溶液能够腐蚀橡胶,应该用酸式滴定管盛装;滴定完成时NaHSO
3溶液没有剩余,溶液会呈高锰酸钾溶液的颜色,且半分钟内颜色不褪去,就说明NaHSO
3溶液已完全被氧化;
故答案为:酸式滴定管;溶液由无色变浅红色,且半分钟内不褪去;
(3)A、酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大,故A正确;
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对实验无影响,故B错误;
C、定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大,故C正确;
D、观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小,故D错误;
故答案为:AC;
(4)实验2中KMnO
4溶液的体积的偏离较大,舍去不用,由实验1和3取平均值,KMnO
4溶液体积的平均值=
=16.00mL,
设亚硫酸氢钠的物质的量浓度为xmol/L.
2MnO
4-+5HSO
3-+H
+=2Mn
2++5SO
42-+3H
2O.
2mol 5mol
0.0016mol 0.02Cmol
C=O.2
故答案为:16.00;0.2.
点评:本题考查了物质的量的有关计算、离子方程式的配平等知识点,根据氧化还原反应中得失电子数相等来配平即可,难度不大.



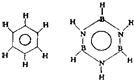 巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( ) 1mol C6H6与H2加成时:Ⅰ需
1mol C6H6与H2加成时:Ⅰ需 立体结构:该结构的二氯代物有
立体结构:该结构的二氯代物有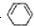 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯