
在实验室用下列装置(固定、加热仪器和橡胶管已略)进行有关氨气的制取和性质实验探究。
请回答下列问题:
(1)若用装置①制取NH3,其反应的化学方程式为:
若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号,下同),装置中所盛试剂应具有的性质是____________________________________________________。
(2)若用装置②制取并收集干燥的NH3,检验该装置气密性的方法是_______________
。收集装置应选择________。证明氨气已收集满的操作是_______________________________ _____________________________________________________________。
(3)将氨气通过灼热的氧化铜粉末,得到氮气和铜,写出该反应的化学方程式,并写出单线桥________________________________________________________________________。
要制取并收集纯净的氮气(可含有少量的水),应使用上述仪器中的(按气流方向从左向右列出):②→________。此时③中应盛放________。
科目:高中化学 来源: 题型:
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是______________,a的范围是 。
(2)由不溶物E生成溶液D的化学方程式为____________________________。
(3)滤液A中加入H2O2反应的离子方程式为 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:
氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣
3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2⇌KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是(用化学式表示);CCl4中显紫红色的物质 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.
写出潮湿环境下KI与氧气反应的化学方程式: .
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2.
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Al、Fe是生活中常见的金属元素。
⑴工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程
①将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中②通入过量二氧化碳使①所得溶液中析出氢氧化铝固体③使氢氧化铝脱水生成氧化铝④电解熔融氧化铝生成铝。写出②所涉及的离子方程式: ,蒸干AlCl3溶液不能得到无水AlCl3,若使SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,用化学方程式解释:
⑵铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石、赤铁矿石等。红热的铁能跟水蒸气反应,则其反应的化学方程式为 。其生成黑色的物质溶于酸后,加入KSCN,见不到血红色产生,其原因是 、
(用离子方程式解释)工业炼铁常用赤铁矿与Al在高温下反应制备,写出方程式: 。
⑶钠的化合物中,其中纯碱显碱性的原因: ,(用方程式解释)向饱和的纯碱溶液中通入过量的二氧化碳有晶体析出,写出离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子能大量共存的是
A.紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO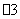
B.无色透明的溶液中:Cu2+、K+、SO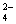 、NO
、NO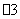
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH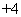 、SO
、SO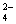 、Cl-
、Cl-
D.无色酚酞试液呈红色的溶液中:Na+ 、K+、SO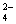 、CO
、CO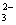
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不能用离子方程式CO32-+2H+=CO2↑+H2O表示的是
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O B.CaCO3+2HCl=CaCl2+H2O+CO2↑
C.K2CO3+H2SO4=K2SO4+CO2↑+H2O D.K2CO3+2HNO3=2KNO3+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
.香豆素是一种天然香料,存在于黑香豆、兰花等植物中.工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:
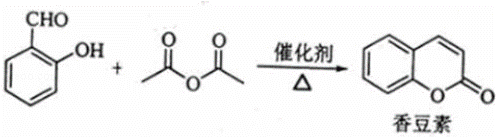
以下是甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去):
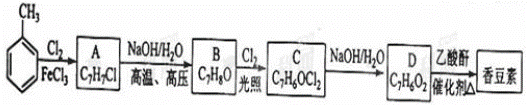
已知以下信息:
①A中有五种不同化学环境的氢:
②B可与FeCl3,溶液发生显色反应:
③同一个碳原子上连有两个烃通常不稳定,易脱水形成羰基
请回答下列问题:
(1)香豆素的分子式为 .
(2)D的结构简式为 .
(3)由B生成C的化学反应方程式为 .
(4)B的同分异构体中含有苯环的还有 种,其中在核磁共振氢谱中峰面积之比为1:2:2:2:1的B的同分异构体为 (写结构简式).
(5)写出满足下列条件的D的同分异构体 (写结构简式).
①含有苯环 ②能与碳酸氢钠溶液反应放出CO2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com