
| A. | 丙烯分子有7个σ键和1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp2杂化 | |
| C. | 丙烯分子中3个碳原子在同一直线上 | |
| D. | 丙烯分子中既存在非极性键又存在极性键 |
分析 A、C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
B、甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化;
C、由C=C双键为平面结构、甲基为四面体结构分析;
D、同种非元素之间形成非极性键,不同种元素形成的是极性键.
解答 解:A、C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A错误;
B、甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,则丙烯分子中1个碳原子是sp3杂化,2个碳原子是sp2杂化,故B错误;
C、由C=C双键为平面结构、甲基为四面体结构可知,丙烯分子中2个碳原子在同一直线,故C错误;
D、同种非元素之间形成非极性键,则丙烯中存在C-C非极性共价键,又存在C-H极性键,故D正确;
故选D.
点评 本题考查共价键及分类,注意判断共价键的规律和常见有机物的空间结构来解答,杂化类型为解答的易错点,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
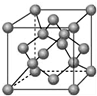 已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子;B的基态原子核外电子有7种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子;B的基态原子核外电子有7种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
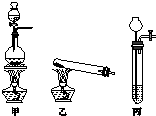 相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 白色沉淀生成 |

| 实验步骤 | 实验现象 | 结论 |
| 实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
| 实验4: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
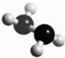 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 32g N2H4中含有共价键的总数为6NA | |
| B. | 标准状况下,22.4LH2O2中所含原子总数为4NA | |
| C. | 28g N2中含电子总数为7NA | |
| D. | 与17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com