

(1)若两池中均盛有CuSO4溶液,反应一段时间后,有红色物质析出的是甲池中的________棒,乙池中的________棒。
(2)若两池中均盛有饱和的NaCl溶液,
①写出甲池中铁极上的电极反应式:______________________________________________;
②写出甲池中炭极上的电极反应式:______________________________________________;
③写出乙池中总反应的离子方程式:______________________________________________;
④若乙池中通过0.02 mol电子后停止实验,测得池中溶液的体积是200 mL,则溶液混匀后的pH为__________。
(1)炭 铁
(2)①Fe-2e-====Fe2+ ②2H2O+O2+4e-====4OH- ③2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ ④13
2OH-+H2↑+Cl2↑ ④13
解析:观察甲、乙装置,甲无电源,为原电池,且Fe为负极,C棒为正极;乙有电源为电解池且Fe为阴极,C棒为阳极。当两池中盛有CuSO4溶液时,在甲中,Cu2+应在正极得电子生成Cu,即炭棒上有红色物质Cu生成;在乙中,Cu2+应在阴极得电子生成Cu,即铁棒上有红色物质Cu生成。当两池中盛有NaCl溶液时,对甲相当于铁的吸氧腐蚀,故铁极(即负极)上的电极反应式:Fe-2e-====Fe2+,炭极(正极)上的电极反应式:O2+2H2O+4e-====4OH-;对乙相当于电解饱和食盐水,总反应式:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,若通过0.02 mol电子(即有0.02 mol电子转移),则溶液中有0.02 mol OH-,c(OH-)=
2OH-+H2↑+Cl2↑,若通过0.02 mol电子(即有0.02 mol电子转移),则溶液中有0.02 mol OH-,c(OH-)=![]() =0.1 mol/L,其pH=13。
=0.1 mol/L,其pH=13。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
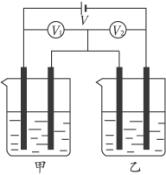
A.V1和V2都不变 B.V1和V2都变大
C.V1变大,V2变小 D.V1变小,V2变大
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)、如下图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题:
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH—)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的
A.盐酸 B. NaCl固体 C. NaCl溶液 D. HCl气体
(2)若两池中均盛有200mL 2mol•L-1CuSO4溶液:
①反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②写出乙池通电时总反应的离子方程式: 。
③若乙池中通过1.2mol 电子后停止实验,则乙池中共可收集到气体的体积为(标准状况下)
查看答案和解析>>
科目:高中化学 来源:2009—2010学年福州八中高二下学期期中考试化学卷 题型:填空题
(15分)、如下图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题: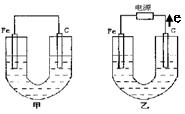
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH—)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的 
| A.盐酸 | B.NaCl固体 | C.NaCl溶液 | D.HCl气体 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com