
【题目】实验室中常用下列反应制取氯气:MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2 H2O
MnCl2 + Cl2↑+ 2 H2O
(1)用双线桥或单线桥的方式表示该反应电子转移的方向和数目:________
(2)该反应中还原剂是________;
(3)标准状况下,收集到2.24 L Cl2时,被氧化的还原剂的物质的量为_____mol,转移电子的物质的量为____mol。
【答案】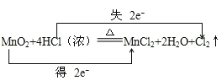 或
或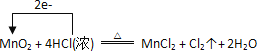 HCl 0.2 0.2
HCl 0.2 0.2
【解析】
(1) 该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为2;
(2) 所含元素化合价升高的物质是还原剂;
(3)标准状况下,2.24 L Cl2的物质的量为![]() =0.1mol,结合反应原理分析即可。
=0.1mol,结合反应原理分析即可。
(1) 该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为2,则转移电子方向和数目为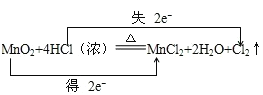 或用单线桥表示转移电子方向和数目为
或用单线桥表示转移电子方向和数目为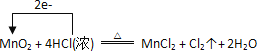 ;
;
(2)在MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2 H2O中氯元素的化合价部分由-1价升高为0价,则还原剂是HCl;
MnCl2 + Cl2↑+ 2 H2O中氯元素的化合价部分由-1价升高为0价,则还原剂是HCl;
(3) 标准状况下,2.24 L Cl2的物质的量为![]() =0.1mol,有原子守恒可知,被氧化的还原剂的物质的量为0.1mol×2=0.2mol,转移电子的物质的量为0.2mol×1=0.2mol。
=0.1mol,有原子守恒可知,被氧化的还原剂的物质的量为0.1mol×2=0.2mol,转移电子的物质的量为0.2mol×1=0.2mol。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
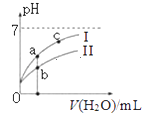
A.Ⅰ曲线代表HClO,Ⅱ曲线代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO32-
C.图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是( )
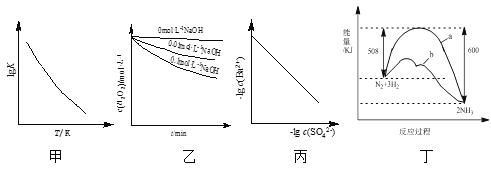
A.图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的lgK与反应温度T的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的lgK与反应温度T的关系曲线,说明该反应的ΔH<0
B.图乙是70℃时不同pH条件下H2O2浓度随时间的变化曲线。说明其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO![]() )的关系曲线,说明溶液中c(SO
)的关系曲线,说明溶液中c(SO![]() )越大c(Ba2+)越小
)越大c(Ba2+)越小
D.图丁是合成氨反应过程中能量变化曲线,说明该反应为放热反应,且b表示在反应体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)已知:H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH1=61kJ·mol-1
SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(g) ΔH3=110kJ·mol-1
则硫化氢气体分解为氢气和固体硫的热化学方程式为___。
(2)K2CO3溶液吸收H2S的反应为K2CO3+H2S![]() KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
(已知:H2CO3lgK1=-6.4,lgK2=-10.3;H2SlgKl=-7.0,lgK2=-19.0)。
(3)工业上采用图1所示装置电解K4[Fe(CN)6]和KHCO3混合溶液一段时间,然后停止电解,通入H2S,利用生成的K3[Fe(CN)6]将H2S转化为S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___。
②通入H2S过程中,伴有CO![]() 转化为HCO
转化为HCO![]() 。通H2S发生反应的离子反应方程式为___。
。通H2S发生反应的离子反应方程式为___。

(4)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图2所示。t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是___。

(5)H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图3所示,H2S的电离平衡常数Ka1=___。写出pH由12.0变为16.0时发生的主要的离子方程式:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常常需要对混合气体中的NOx含量进行测定,其中一种方法的操作如下:①将200L气样通入酸化的H2O2溶液中,使NOx完全被氧化为NO![]() ,加水稀释至100.00mL;②微微加热,除去过量的H2O2;③量取20.00mL该溶液,加入20mL8.000×10-2mol·L-1FeSO4溶液(过量),充分反应;④用5.000×10-3mol·L-1K2Cr2O7溶液滴定剩余的Fe2+,终点时消耗20.00mL。
,加水稀释至100.00mL;②微微加热,除去过量的H2O2;③量取20.00mL该溶液,加入20mL8.000×10-2mol·L-1FeSO4溶液(过量),充分反应;④用5.000×10-3mol·L-1K2Cr2O7溶液滴定剩余的Fe2+,终点时消耗20.00mL。
(1)能使气样中的NOx更好地被H2O2溶液氧化的操作是___。
(2)NO被H2O2氧化为NO3-的离子方程式是___。
(3)若缺少步骤②,对混合气体中NOx含量的测定结果将___(填“偏大”或“偏小”或“无影响”)。
(4)滴定过程中发生下列反应(未配平):
Fe2++NO![]() +H+——NO↑+Fe3++H2O
+H+——NO↑+Fe3++H2O
Cr2O![]() +Fe2++H+——Cr3++Fe3++H2O
+Fe2++H+——Cr3++Fe3++H2O
则气样中NOx折合成NO2的含量为___mg·m-3。(保留4位有效数字)(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.17g-OH中含有的电子数为10NA
B.25°C时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C.1L1molL-1CH3COONH4溶液中CH3COO-与NH4+数目均为NA
D.含0.5mol晶胞(下图)的Cu2O晶体中Cu2+的数目为2NA

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝,工艺流程如图:
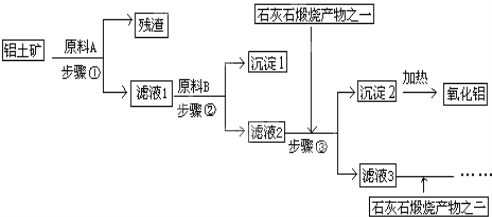
(1)原料A的名称是______,步骤①反应的离子方程式是__________、 ________;
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的子方程式是:________________、 ____________、 _____________;
(3)步骤③主要的化学方程式是:_________;
(4)滤液3中的离子主要有______, 该流程中哪些物质可循环使用_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com