
【题目】分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
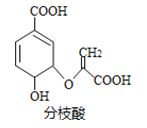
A. 分子中含有5种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
科目:高中化学 来源: 题型:
【题目】一定量的Na2O2与CO2反应,得到固体物质41.8 g,恰好与1 L 1 mol·L-1的稀盐酸完全反应。下列说法正确的是( )
A. 41.8 g固体物质为Na2CO3
B. 41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物
C. 一定量的Na2O2为78 g
D. 41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的装置中正确的是_______(填字母)。


漂白粉能与盐酸发生反应,但盐酸浓度不同时,漂白粉与盐酸混合发生反应的类型不同。
漂白粉与稀盐酸发生复分解反应,化学方程式为_________________________。漂白粉与浓盐酸发生氧化还原反应,化学方程式为____________________________________。
(2)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。

①能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
②c过程中的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太阳能分解10mol水消耗的能量是____________kJ;
(2)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
则由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。
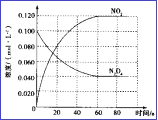
(3)在容积为1.00L的容器中,通入一定量N2O4,发生N2O4(g) ![]() 2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________kJ。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 若k正 = 0.0027min-1,在t=40min时,v正=_______min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下二氯化二硫(S2 Cl2)为红棕色液体,其结构式为Cl-S-S-Cl。其制备反应及与水反应的化学方程式如下:①CS2+3Cl2 ![]() CCl4+S2Cl2 ②2S2Cl2 +2H2O=4HCl+SO2↑+3S↓则下列说法正确的是 ( )
CCl4+S2Cl2 ②2S2Cl2 +2H2O=4HCl+SO2↑+3S↓则下列说法正确的是 ( )
A. 反应①中CS2作氧化剂
B. 反应②中S2Cl2既作氧化剂又作还原剂
C. 反应①中每生成1mol S2Cl2转移4mol电子
D. 反应②中氧化产物与还原产物的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:(提示:SiO2为难溶于盐酸的固体)

请回答下列问题:
(1)固体a的化学式为________。
(2)在Ⅱ中加过量的烧碱涉及到的反应离子方程式有Fe3+ + 3OH- =Fe(OH)3↓、H+ + OH- =H2O、_________________;Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(3)由Ⅲ中得到滤液c的实验操作为_____________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)_________________________。
(4)0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合的离子反应方程式为_____________________________________。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和加入的H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol/L,则此时v(正)<v(逆)
C. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D. 恒温时将气体体积缩小到原来的一半,达到新平衡时CO浓度将要减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
下列推断正确的是( )
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后, c(CO32-)>c(HCO3-)
D. 25℃时等浓度的NaCN和NH4Cl溶液,前者的阴离子浓度之和大于后者的阳离子浓度之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com