
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 该反应平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ | |
| D. | 溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变 |
分析 A.沉淀的转化向溶度积更小的方向移动;
B.开始浓度未知,不能确定平衡浓度的关系;
C.K=$\frac{c(F{e}^{2+})}{c(C{u}^{2+})}$;
D.加入少量Na2S固体后,CuS更难溶,Cu2+、S2-发生反应生成沉淀.
解答 解:A.沉淀的转化向溶度积更小的方向移动,可知FeS的Ksp大于CuS的Ksp,故A错误;
B.开始浓度未知,不能确定平衡浓度的关系,则c(Fe2+)、c(Cu2+)平衡时不一定相等,故B错误;
C.K=$\frac{c(F{e}^{2+})}{c(C{u}^{2+})}$=$\frac{c(F{e}^{2+})×c({S}^{2-})}{c(C{u}^{2+})×c({S}^{2-})}$=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$,故C正确;
D.加入少量Na2S固体后,CuS更难溶,先Cu2+、S2-发生反应生成沉淀,则溶液中c(Cu2+)减小,故D错误;
故选C.
点评 本题考查难溶电解质的转化,为高频考点,把握沉淀转化的实质、K与Ksp的关系为解答的关键,侧重分析与应用能力的考查,注意溶度积小的先转化为沉淀,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2p能级上只有1个空轨道的原子和3p能级上只有1个空轨道的原子 | |
| B. | 最外层电子排布为3s2的原子和最外层电子排布为4s2的原子 | |
| C. | 最外层电子排布为ns2的原子和最外层电子排布为ns2np6的原子 | |
| D. | 2p能级上有2个未成对电子的原子和3p能级上有2个未成对电子的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用双氧水代替高锰酸钾制氧气 | |
| B. | 用多量的氯气进行性质实验 | |
| C. | 用溴水代替碘水进行萃取实验 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
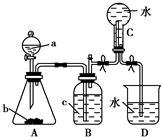 如图装置是某种气体X的制取装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水.请回答下列问题:
如图装置是某种气体X的制取装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
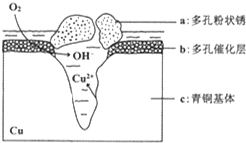 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度 | 283K | 293K | 303K |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 出现白色沉淀,说明该试剂中有Ba2+存在 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加稀盐酸连接带塞导气管将产生的气体导入澄清石灰水中. | 澄清石灰水变混浊.说明该试剂中含有BaCO3 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测其pH值 | pH值明显大于9.6,说明该试剂中含有Ba(OH)2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com