
(14分) 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装
置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。然后再将NaHCO3制成
Na2CO3。

(1)装置乙的作用是 。为防止污染空气,尾气中含有的 需要进行吸收处理。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、 、 。
NaHCO3转化为Na2CO3的化学方程式为 。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
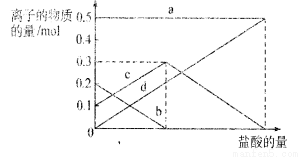
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如右图所示。
则曲线c对应的溶液中的离子是
(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 。
(4)若取21. 0 g NaHCO3固体,加热了t2 min后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol·L-1的盐酸中则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)。
(1)除去二氧化碳中的氯化氢气体(2分) 氨气 (1分)
(2)过滤、洗涤、灼烧 (各1分) 2NaHCO3 Na2CO3+H2O+CO2↑(2分)
Na2CO3+H2O+CO2↑(2分)
(3)HCO3- (2分) 1:2 (2分) (4) 0.75 mol/L(2分)
【解析】
试题分析:(1)装置甲是制备二氧化碳气体的反应装置,生成的二氧化碳气体中含有氯化氢气体,对制备碳酸氢钠有影响,装置乙的作用是吸收氯化氢气体;最后的尾气中含有氨气不能排放到空气中,需要进行尾气吸收;故答案为:吸收HCl;NH3;(2)由装置丙中产生的NaHCO3发生的反应为,NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;制取Na2CO3时需要过滤得到晶体,洗涤后加热灼烧得到碳酸钠;故答案为:过滤、洗涤、灼烧;(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应 CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸氢根离子浓度变化;碳酸根离子浓度0.2mol/L;碳酸氢根离子浓度为0.1mol/L;样品中NaHCO3和Na2CO3的物质的量之比是1:2;故答案为:HCO3-; 1:2;(4)若取21g NaHCO3固体物质的量为0.25mol ,加热了t2min后,剩余固体的质量为14.8g.依据化学方程式存在的质量变化计算: 2NaHCO3=Na2CO3+CO2↑+H2O△m
2 1 62
0.2mol 0.1mol 21g-14.8g
反应后NaHCO3物质的量=0.25mol-0.2mol=0.05mol;NaHCO3+HCl=NaCl+H2O+CO2↑;消耗氯化氢物质的量0.05mol; Na2CO3物质的量=0.1mol,Na2CO3+2HCl=2NaCl+H2O+CO2↑,消耗氯化氢物质的量0.2mol;剩余氯化氢物质的量=0.200L×2mol/L-0.05mol-0.2mol=0.15mol,剩余溶液中c(H+)=0.75mol/L
考点:考查物质的量的有关计算、化学实验基本操作、元素化合物等相关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届浙江省杭州市高一上学期期末模拟考试化学试卷(解析版) 题型:选择题
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2。他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)( )
A.0.448L B.2.240L C.2.016L D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期主族元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市高一上学期期末考试化学试卷(解析版) 题型:选择题
能正确表示下列化学反应的离子方程式是
A.碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.工业制备氯气:2NaCl+2H2O 2Na+ +2OH-+H2↑+Cl2↑
2Na+ +2OH-+H2↑+Cl2↑
C.金属钠与足量盐酸反应:2Na + 2H+=2Na+ + H2↑
D.硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质的分类正确的是
碱酸盐碱性氧化物酸性氧化物
ANaOHH2SO4BaCO3SO2CO2
BBa(OH)2HClNaClNa2OCO
CNaOHCH3COOHCaCl2COSO2
DKOHHClOCaCO3CaOSO3
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市八校高一上学期期末联考化学试卷(解析版) 题型:选择题
向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,若所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比为:
A.3︰14 B.1︰7 C.2︰7 D.3︰2
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市八校高一上学期期末联考化学试卷(解析版) 题型:选择题
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液
②过量NaOH溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液
④Na2O2投入FeCl3溶液
A.①④ B.②③④ C.②③ D.①③④
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高一下学期第一次质量检测化学试卷(解析版) 题型:填空题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):

(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)D中干燥管中出现的现象是 ,化学方程式 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂 。
(5)还有什么方法能证明氧化性Cl2>S ,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高一上学期第一次质检化学试卷(解析版) 题型:选择题
向饱和石灰水中不断通入二氧化碳,其溶液导电性的变化是( )
A.由弱变强 B.由强变弱
C.由强变弱,再变强 D.由弱变强,再变弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com