
分析 (A)取试液适量,加入过量稀盐酸,有气体生成,则溶液中含有离子CO32-,则一定不含Ag+、Ba2+、Al3+、Fe3+,这些离子与CO32-离子反应生成沉淀而不能大量共存,根据溶液的电中性,溶液中一定存在Na+离子,溶液无色,则不含MnO4-;
(B)溶液甲呈酸性,再加入过量碳酸氢铵溶液,有气体生成,析出白色沉淀,甲中应含有Al3+离子,则原溶液中应含有AlO2-离子;
(C)向溶液丙中加入过量Ba(OH)2溶液,有气体生成,该气体为氨气,溶液丙中碳酸氢铵过量,加入氢氧化钡溶液析出白色沉淀,该沉淀为碳酸钡沉淀.
解答 解:(1)取试液适量,加入过量稀盐酸,有气体生成,则溶液中含有离子CO32-,则一定不含Ag+、Ba2+、Al3+、Fe3+,这些离子与CO32-离子反应生成沉淀而不能大量共存,根据溶液的电中性,溶液中一定存在Na+离子,
溶液无色,则不含MnO4-,
故答案为:Ag+、Ba2+、Al3+、Fe3+、MnO4-;
(2)根据(1)的分析和解答,溶液中含有CO32-和Na+离子,溶液甲呈酸性,再加入过量碳酸氢铵溶液,有气体生成,析出白色沉淀,应是发生:Al3++3HCO3-=Al(OH)3↓+3CO2↑,甲中应含有Al3+离子,则原溶液中应含有AlO2-离子,
故答案为:Na+、AlO2-、CO32-;
(3)步骤C是在过量的碳酸氢铵溶液里加入过量氢氧化钡溶液,生成氨气和碳酸钡沉淀,发生的离子反应为Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3↑+2H2O,
故答案为:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3↑+2H2O.
点评 本题考查了常见离子的检验方法,题目难度不大,注意根据溶液呈电中性判断溶液中存在的离子方法,本题充分考查了学生的分析、理解能力,要求熟练掌握常见离子的检验方法.


科目:高中化学 来源: 题型:选择题
| A. | 同种元素构成的物质一定是单质 | |
| B. | 知道某元素核内的质子数和中子数,就能确定该元素的相对原子质量 | |
| C. | 所有原子都是由原子核、核外电子构成,而原子核又由质子、中子构成的 | |
| D. | 元素的同位素是由原子核内的质子数和中子数决定的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 垃圾处理的方法只有卫生填埋和焚烧 | |
| B. | 将垃圾分类并回收利用是垃圾处理的发展方向 | |
| C. | 填埋垃圾不需要处理,只深埋即可 | |
| D. | 焚烧垃圾会产生大量污染空气的物质,故绝不宜采用此法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
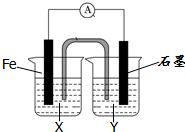 理论上任何一个自发的氧化还原反应均可以设计成原电池,根据氧化还原反应:Fe+2Fe3+=2Fe2+设计的原电池如图所示,其中盐桥内盛装有含KNO3饱和溶液的琼脂.
理论上任何一个自发的氧化还原反应均可以设计成原电池,根据氧化还原反应:Fe+2Fe3+=2Fe2+设计的原电池如图所示,其中盐桥内盛装有含KNO3饱和溶液的琼脂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com