
【题目】化合物W(![]() )、M(
)、M(![]() )、N(
)、N(![]() )的分子式均为C7H8。下列说法正确的是
)的分子式均为C7H8。下列说法正确的是
A. W、M、N均能与溴水发生加成反应
B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面
D. W、M、N均能使酸性KMnO4溶液褪色
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。
⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用,请回答下列问题:
(1)写出砷(As)的基态原子的电子排布式_________。
(2)N、P、As为同一主族元素,其电负性从大到小的顺序为_______,它们的简单氢化物沸点最高的是______,将NaNO2和Na2O在一定的条件下反应得到一种白色晶体,已知其中的阴离子与SO42-互为等电子体,则该阴离子的化学式为________。
(3)Fe3+、Co3+、N3+-、CN-等可形成络合离子。
①K3Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为________。
②[Co(N3)(NH3)5]SO4中Co的配位数为_______,其配离子中含有的化学健类型为_____(填离子键、共价键、配位键),C、N、O的第一电离能最大的是_____,其原因是_______。
(4)砷化镓晶胞结构如图。晶跑中Ga与周围等距且最近的砷形成的空间构型为_____,已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的数值为______(列出计算式即可)。
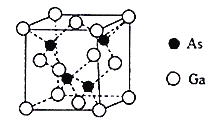
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时消耗2nmolNO2
②单位时间内生成nmolO2的同时消耗2nmolNO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
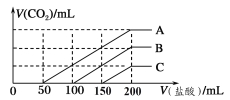
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
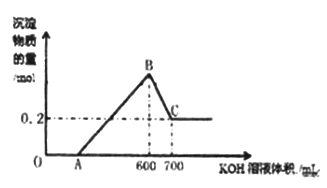
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
(1)参照下图B、F元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出C、N、O三种元素的相对位置。_________
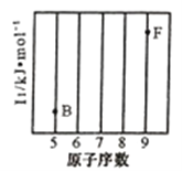
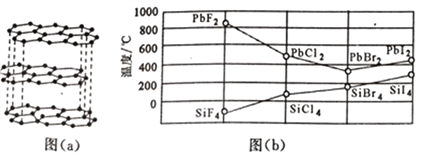
(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为__________________。
(3)二卤化铅PbX2的熔点如图(b)所示,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性__________(填“增强”、“ 不变”或“减弱”,下同),共价性__________。
(4)NH3和F2在Cu催化下可发生反应4NH3+3F2![]() NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____(填序号)。写出基态铜原子的价电子排布式_____________。
NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____(填序号)。写出基态铜原子的价电子排布式_____________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
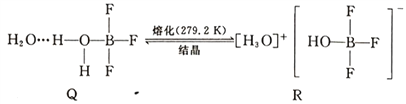
晶体R中含有的化学键包括____________。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的Ka2_________苯酚(
,相同温度下,水杨酸的Ka2_________苯酚(![]() )的Ka(填“>”“ =”或“<”),其原因是_______________。
)的Ka(填“>”“ =”或“<”),其原因是_______________。
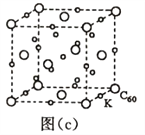
(7)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为_____________;其晶胞参数为1.4nm,阿伏加德罗常数用NA表示,则晶体的密度为_________g·cm-3。(只需列出式子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2=2M3++2R-
③2![]() +Z2=R2+2
+Z2=R2+2![]() 。由此判断下列说法正确的是
。由此判断下列说法正确的是
A.氧化性强弱顺序为XO42->Z2>R2>M3+
B.Z2在③中发生氧化反应
C.R元素在反应②中被氧化,在③中被还原
D.常温下反应不可进行2M2++Z2=2M3++2Z-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com