
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源:2013-2014学年山东省潍坊市高三上学期期末考试化学试卷(解析版) 题型:填空题
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
|
电解质 |
电离方程式 |
电离常数K |
Ksp |
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
- |
|
C6H5OH |
C6H5OH |
1.1×10-10 |
- |
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 |
- |
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
- |
|
BaSO4 |
BaSO4(s) |
- |
1.07×10-10 |
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:_________________。
(2)25℃时,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子浓度关系正确的是__________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01 mol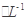 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=____mol/L。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
①T2____ 25℃(填“>”、“<”或“=”);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是____(填序号)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二“零诊”考试化学试卷(解析版) 题型:填空题
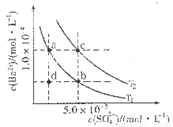
(9分) (1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。

①100°C时1mol·L﹣1的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,KW(25°C)
KW(100°C)
(填“>”、“<”或“=”)。
②25°C时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是 (填“促进”“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
|
化学式 |
电离常数(25℃) |
|
HCN |
K=4.9×l0-10 |
|
CH3COOH |
K=1.8×l0-5 |
|
H2CO3 |
K1=4.3×l0-7、K2=5.6×l0-11 |
③25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为 。
④25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,混合后所得溶液显碱性,则c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
⑤向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源:济南一模 题型:问答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
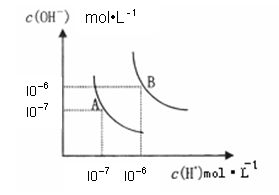 (1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。100°C时1 mol·L﹣1 的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,
(1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。100°C时1 mol·L﹣1 的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,
KW(25°C) KW(100°C)(填“>”、“<”或“=”之一)。25°C时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是 (填“促进”“抑制”或“不影响”之一)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小
的顺序为 。
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则
c(Na+) c(CH3COO-)(填“>”、“<”或![]() “=”之一)。
“=”之一)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,向10VmL pH=a的盐酸中滴加pH=b的NaOH溶液VmL,溶液中Cl-的物质的量恰好等于加入Na+的物质的量。则此时a+b的值为( )
A.13 B.14 C.15 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com