
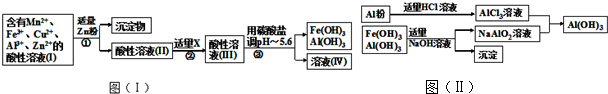
分析 (1)反应中锰元素化合价从+4价降为+2价,硫化亚铁中二价铁化合价升高为三价铁离子,-2价的硫化合价升高为单质硫中的0价,依据氧化还原反应得失电子守恒配平方程式;
(2)a.锌可以Cu2+和Fe3+反应;
b.MnO2可将Fe2+氧化成Fe3+;
c.溶液(IV)为氯化锌、氯化锰溶液,用惰性电极电解,阳极二价锰离子失去电子发生氧化反应,结合水生成氧化锰;
(3)a.AlCl3溶液和NaAlO2溶液发生双水解反应反应生成AI(OH)3;
b.由方程式可知生成4molAI(OH)3需要1molAl3+和3molAlO2-;
解答 解:(1)反应中锰元素化合价从+4价降为+2价,硫化亚铁中二价铁化合价升高为三价铁离子,-2价的硫化合价升高为单质硫中的0价,要使反应中得失电子守恒,则二氧化锰系数为3,硫化亚铁系数为2,依据原子个数守恒可知反应方程式为:3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S↓+6H2O;
故答案为:3,2,6,3,1,2,6;
(2)a.锌可以Cu2+和Fe3+反应,方程式为:Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+,
故答案为:Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+;
b.X是MnO2,MnO2可将Fe2+氧化成Fe3+,便于通过调节pH值除去三价铁离子;
故答案为:将Fe2+氧化成Fe3+;
c.溶液(IV)为氯化锌、氯化锰溶液,用惰性电极电解,阳极二价锰离子失去电子发生氧化反应,结合水生成氧化锰,电解反应式为:Mn2+-2e-+2H2O=Mn+4H+;
故答案为:Mn2+-2e-+2H2O=Mn+4H+;
(3)a.AlCl3溶液和NaAlO2溶液发生双水解反应反应生成AI(OH)3,离子方程式:Al3++3AlO2-+6H2O=4Al(OH)3↓;
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
b.由方程式Al3++3AlO2-+6H2O=4Al(OH)3↓;可知生成4molAl(OH)3需要1molAl3+和3molAlO2-,即由铝单质生成1molAl3+需要3mol盐酸和由氢氧化铝与氢氧化钠反应生成3molAlO2-需要3mol氢氧化钠,即消耗的NaOH和HCl的理论量(mol)都为$\frac{3n}{4}$mol,
故答案为:$\frac{3n}{4}$mol;$\frac{3n}{4}$mol;
点评 本题为综合题,考查了氧化还原反应方程式的配平,物质的分离和提纯,明确氧化还原反应规律,准确把握离子方程式书写方法是解题关键,题目难度中等.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题
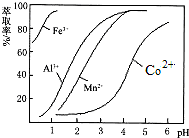
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
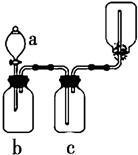 下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )
下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )| 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A. | A | B. | B | ||
| C. | C D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
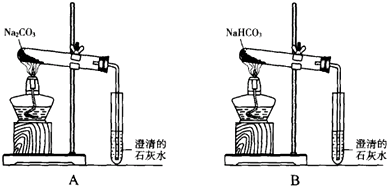
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
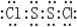 .Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
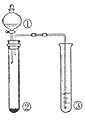 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2S | CuSO4 | 酸性:H2S>H2SO4 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com