
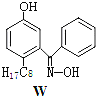
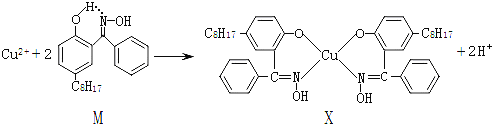
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
(1)关于M所含元素的说法正确的是______________。
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有_______(填序号)。
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________。
(4)基态Cu2+的外围电子排布图为________________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是_____________________________________________________________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。
①该晶体的化学式为_______________。(用元素符号表示)
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为_______________pm(只写计算式)。
【答案】ACBEM能形成分子内氢键,使溶解度减小![]() 3d轨道上没有未成对电子(3d轨道上电子为全空或全满)CuCl共价
3d轨道上没有未成对电子(3d轨道上电子为全空或全满)CuCl共价![]() ×
×![]() ×1010或
×1010或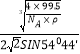 ×1010或
×1010或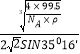 ×1010
×1010
【解析】
(1)M所含元素为C、H、O、N;
A.元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小;
B.同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O;
C.由结构简式可知N原子共形成3对共价键,1个配位键,即N原子采取sp2杂化;
D.芳香烃是含有苯环的烃,只含碳氢两种元素;
E.元素的非金属性越强,氢化物越稳定,以此解答。
(2)酚羟基中O-H间断裂,铜离子与O原子、N原子之间形成配位键,据此解答即可;
(3)分子内氢键的存在,导致水溶性减小,据此解答即可;
(4)根据核外电子排布规律书写Cu原子的核外电子排布式,电子按能层高低进行失去,进而书写Cu2+的外围电子排布图;判断Sc3+、Zn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色;
(5)①Y原子最高价氧化物对应水化物的酸性最强,可知Y是氯元素(Cl),该晶胞中铜原子个数=4,Cl原子个数=8× 1/8 +6× 1/2=4;
②电负性差大于1.7的键一般是离子键,小于1.7的一般为共价键,据此判断;
③Cu原子与周围的4个Cl原子形成正四面体结构,正四面体体心的Cu与晶胞顶点Cl原子距离最短,它们的连线处于晶胞体对角线上,且为晶胞体对角线长度的 1/4 ,根据晶胞含有原子数目计算晶胞质量,结合密度计算晶胞体积,进而计算晶胞棱长,晶胞体对角线长度为棱长的 ![]() 倍。
倍。
(1)A.元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小,故电负性由大到小顺序:O>N>C>H,A正确;
B.同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O,所以第一电离能从大到小的顺序为:N>O>C,B错误;
C.由结构简式可知N原子共形成3对共价键,1个配位键,即N原子采取sp2杂化,故C正确;
D.芳香烃是含有苯环的烃,故M不属于芳香烃,D错误;
E.元素的非金属性越强,氢化物越稳定,则组成M元素的氢化物稳定性:CH4<NH3<H2O,故E错误;
因此,本题答案为:AC;
(2)M中酚羟基中O-H间断裂,铜离子与O原子、N原子之间形成配位键,
因此,本题答案为:BE;
(3)由于M能形成分子内氢键,使溶解度减小,
因此,本题答案为:M能形成分子内氢键,使溶解度减小;
(4)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故基态Cu2+的外围电子排布图为![]() ,Zn2+离子的原子核外排布式为1s22s22p63s23p63d10,d轨道上有10个电子,故Zn2+无色,Sc3+离子的原子核外排布式为1s22s22p63s23p6,其d轨道上有0电子,处于全空,故没有颜色,
,Zn2+离子的原子核外排布式为1s22s22p63s23p63d10,d轨道上有10个电子,故Zn2+无色,Sc3+离子的原子核外排布式为1s22s22p63s23p6,其d轨道上有0电子,处于全空,故没有颜色,
因此,本题答案为:![]() ;3d轨道上没有未成对电子(3d轨道上电子为全空或全满);
;3d轨道上没有未成对电子(3d轨道上电子为全空或全满);
(5)Y原子最高价氧化物对应水化物的酸性最强,可知Y是氯元素(Cl)。
①该晶胞中铜原子个数=4,Cl原子个数=8× 1/8 +6× 1/2 =4,所以其化学式为CuCl;
②铜和的电负性相差3.01.9=1.1,电负性差大于1.7的键一般是离子键,小于1.7的一般为共价键,故Cu与Y形成的化合物属于共价化合物,故答案为:共价;
③四面体的中心原子与两个顶点形成的夹角为109°28′,设铜原子与Y原子之间的距离(即中心原子与顶点的距离)为x,立方体边长a,则四面体的边长为 ![]() a,则由余弦定理可得:(
a,则由余弦定理可得:(![]() a)2=x2+x2-2x2cos109°28′,x=
a)2=x2+x2-2x2cos109°28′,x=![]() ,由于cos2α=1-2sin2α,
,由于cos2α=1-2sin2α,
所以cos109°28′=1-sin254°44′,1-cos109°28′=sin254°44′,x=![]() ,
,
晶体体积为 zM/NAρ,z表示一个晶胞中含有的CuCl的数目,已知z=4,
a=![]() ×1010,x=
×1010,x=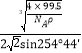 ×1010。
×1010。
由于sin54°44′=cos35°16′,x=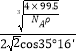 ×1010。
×1010。
四面体顶点到中心的距离与四面体边长的关系为x= ![]() a=
a=![]() a,故x=
a,故x=![]() ×
×![]() ×1010pm。
×1010pm。
因此,本题答案为:![]() ×
×![]() ×1010或
×1010或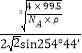 ×1010或
×1010或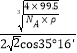 ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是(用NA表示阿伏加德罗常数的值)
A. 17g羟基(-OH)所含有的电子数是10 NA个
B. 常温下,14g乙烯含有的共用电子对数是2.5NA个
C. 12 g石墨中含有C﹣C键的个数为1.5NA
D. 标准状况下,CH4发生取代反应生成22.4LCH2Cl2,需要消耗2NA个Cl2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法不正确的是
A. 苯乙烯所有原子可处于同一平面
B. 由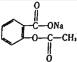 转变为
转变为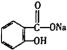 :可与足量NaOH溶液共热后,再通入足量二氧化碳
:可与足量NaOH溶液共热后,再通入足量二氧化碳
C. 蔗糖分子可以看作是两个不同的单糖分子间脱去一个水分子形成的
D. 1mol油脂在酸性条件下充分水解,可制得3mol高级脂肪酸和1mol甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物结构的说法错误的是( )
A.一氯乙烷有两种同分异构体B.苯分子中六个碳碳键键长完全相等
C.乙烯分子中所有原子处于同一平面内D.乙醇的核磁共振谱图中有3个特征峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据有关信息解答下列化学实验问题:
(Ⅰ)醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液反应,生成物是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na
R-CH(OH)-SO3Na
(1)上述反应类型为________反应。若使CH3 CH(OH)-SO3Na全部变成乙醛,可采用的试剂是__________或__________;分离乙醛的操作方法 _____________。
(Ⅱ)实验室利用苯甲醛(安息香醛)制备苯甲醇和苯甲酸的化学原理:
![]() (此原理适用于无α-氢的醛)
(此原理适用于无α-氢的醛)
已知部分物质的性质:
苯甲醇:熔点(℃):-15.3℃,稍溶于水,易溶于有机溶剂;
苯甲醛:熔点(℃):-26℃,微溶于水,易溶于有机溶剂;
苯甲酸:溶解度为0.344g(25℃),易溶于有机溶剂.主要过程如图所示:
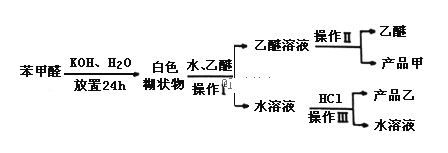
回答下列问题:
(2)操作Ⅰ的名称是___________,乙醚溶液中所溶解的主要成分是__________;
(3)操作Ⅲ的名称是________,产品乙是_______________.
(4)按上述操作所得的产品甲中常含有一定量的有机杂质___________(填写杂质的名称);限用下列试剂:酸性KMnO4、稀NaOH溶液、稀H2SO4、饱和NaHSO3溶液.写出检验产品甲中含有该杂质的过程:______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年12月江西铜业排污祸及下游,据测定废水中重金属污染物和有毒非金属污染物达二十余种,当地民众重金属中毒病症和奇异怪病时有发生. 废水中的重金属指的是( )
A. 金属单质 B. 金属元素 C. 金属铜 D. 金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
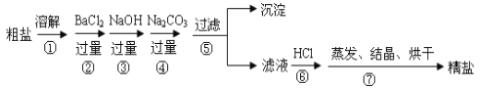
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___________________________。
(2)第②步操作的目的是除去粗盐中的__________(填化学式),判断BaCl2已过量的方法是____________________________________________________________。
(3)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是________________。
(4)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、________、__________。
(5)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、酒精灯、火柴、玻璃棒、______。
(6)第④步除原食盐中杂质离子与碳酸根的反应外还有的反应的离子方程式为:______________________________;
(7)第⑥步操作中涉及反应的离子方程式有:__________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应的离子方程式正确的是( )
A. 2Na+3H+=2Na++H2↑
B. Na+H2O=Na++OH-+H2↑
C. 2Na+2H2O=2Na++2OH-+H2↑
D. 2Na+2H2O=2Na++O2↑+2H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com