
用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g) 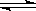 5N2(g)+6H2O(l) ΔH1
5N2(g)+6H2O(l) ΔH1
反应II: 2NO(g)+O2(g) 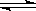 2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
反应III:4NH3(g)+6NO2(g) 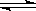 5N2(g)+3O2(g)+6H2O(l) ΔH3
5N2(g)+3O2(g)+6H2O(l) ΔH3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)ΔH3=____________(用ΔH1、ΔH2的代数式表示);推测反应III是________反应(填“吸热”或“放热”)。
(2)相同条件下,反应I在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=______________。
②下列说法不正确的是_______。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如右。溶液中OH?向电极____移动(填a或b),负极的电极反应式为________________。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2017届河北省高三上10月月考化学试卷(解析版) 题型:选择题
向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上10.6周测化学试卷(解析版) 题型:选择题
二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是
H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是
A.NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A)
B.NaHA:c(Na+)>c(HA-)>c(H+)>c(OH-)
C.Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+)
D.H2A:c(H+)=c(HA-)+2c(A2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期第一次月考化学卷(解析版) 题型:选择题
在水中加等物质的量的Ag+、Pb2 +、Na +、 SO42 -、 NO3- 、 Cl-,该溶液放在用惰性电极做电极的电解槽中,通电片刻,则氧化产物与还原产物质量
-、 NO3- 、 Cl-,该溶液放在用惰性电极做电极的电解槽中,通电片刻,则氧化产物与还原产物质量 比为( )
比为( )
A.35.5:108 B. 16:207 C.8:1 D.108:35.5
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期第一次月考化学卷(解析版) 题型:选择题
能正确解释下列反应原理,并书写正确的离子方程式的是( )
A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
B.用小苏打治疗胃酸过多:CO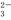 +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu=Fe2++Cu2+
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO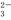 =CaCO3+SO
=CaCO3+SO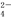
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
下列有关热化学方程式的叙述正确的是
A.已知甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g) =2CO2(g)+2H2O(g) ΔH = - 890.3 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) ΔH >0, 则金刚石比石墨稳定
C.已知中和热为ΔH = -57.4 kJ·mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D.已知S(g)+ O2(g) = SO2(g) ΔH1; S(s)+O2(g) = SO2(g) ΔH2,则ΔH1﹤ΔH2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
在一定条件下,红棕色的NO2可以发生如下反应:2NO2(g) 2NO(g)+O2(g)△H>0,下列叙述中正确的是
2NO(g)+O2(g)△H>0,下列叙述中正确的是
A.恒温恒容,充入NO2气体,其转化率增大
B.加压,平衡向逆反应方向移动,混合气体颜色变深
C.若平衡常数增大,则可能是升高了温度或减小了体系的压强
D.当2v正(NO)=v逆(O2)时,反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学卷(解析版) 题型:实验题
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 编号 | NaOH溶液 的浓度(mol/L) | 滴定完成时,消耗NaOH 溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.02 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.98 | 20.00 |
(1)滴定达到终点的现象是 ;此时锥形瓶内溶液的pH的范围是 。
(2)根据上述数据,可计算出该盐酸的浓度为 。
(3)排去碱式滴定管中气泡的方法应采用右图的 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。


(4)右图是某次滴定时的滴定管中的液面,其读数为________mL。
(5)下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有 。
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月月考化学试卷(解析版) 题型:填空题
Ag/A12O3催化剂在工业上具有广泛用途。废银催化剂中银的回收既可节约资源,又有较好的经济效益。回收银的简化流程如下图所示(部分条件和试剂略):

请回答下列问题:
(1)第I步中,载体A12O3不与稀硝酸反应。Ag和稀硝酸反应产生的气体是____________。
(2)第II步中,饱和食盐水由工业食盐水提纯而得。除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,正确的操作顺序是_________(填字母编号)。
a.加入稍过量的NaOH溶液
b.加入稍过量的BaC12溶液
c.过滤
d.加入稍过量的Na2CO3溶液
e.加入适量盐酸
(3)第III步中,加入氨水使沉淀溶解的离子方程式是____________ 。
(4)N2H4具有还原性,氧化产物为N2。第IV步反应的产物除Ag和N2外,还有的物质是_______(填化学式)。
(5)N2H4可用作火箭推进剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H = -534 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H = -116 kJ/mol
N2(g)+O2(g)=2NO(g) △H = +183 kJ/mol
N2H4和NO2反应生成N2和气态H2O的热化学方程式是______________________。
(6)Ag可制备银锌纽扣电池正极材料Ag2O,碱性条件下该电池的正极反应式是____。
(7)若上述流程中第I、II、III步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,理论上需要加入N2H4的质量是________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com