
 、
、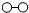 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )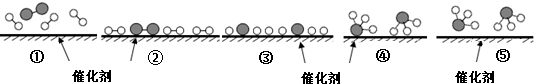
| A. | 使用催化剂,合成氨反应放出的热量减少 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 在该过程中,N原子和H原子形成了含有非极性键的NH3 | |
| D. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
分析 A、催化剂不会改变反应的热效应;
B、由图中可知,每3个氢分子和1个氮气分子生成2个氨分子;
C、氨气是含有氮氢极性键构成的分子;
D、合成氨的反应是放热反应,根据键能和焓变的关系来判断.
解答 解:A、催化剂不会改变反应的热效应,即使用催化剂,合成氨反应放出的热量不会变化,故A错误;
B、由图中可知,每3个氢分子和1个氮气分子断键得到原子,然后生成2个氨分子,生成氨分子之前是氢原子和氮原子,故B正确;
C、氨气是含有氮氢极性键构成的分子,在该过程中,N原子和H原子形成了含有极性键的NH3,故C错误;
D、合成氨的反应是放热反应,反应物断键吸收能量小于生成物形成新键释放的能量,故D错误.
故选B.
点评 本题考查学生反应焓变的计算和影响因素等,解答本题的关键是要充分理解图中提供的信息,只有这样才能对问题做出正确的判断,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验方案 | 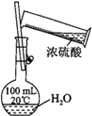 | 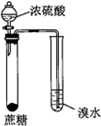 | 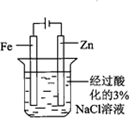 | 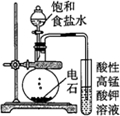 |
| 实验目的 | 配制一定物质的量浓度的硫酸 | 验证浓硫酸具有脱水性、氧化性 | 验证Fe电极被保护 | 用该装置制备并检验乙炔 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题





 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
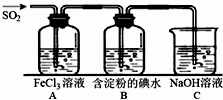 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=0.1mol/L的溶液:Na+、K+、CO32-、ClO- | |
| B. | 滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 含有Fe3+的溶液中:Na+、Al3+、Cl-、SCN- | |
| D. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com