
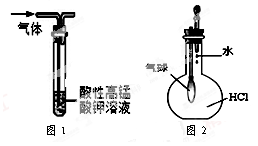
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用图1装置能除去SO2中混有的CO2 |
| C.用图2装置能验证HCl气体在水中的溶解性 |
| D.用25 mL碱式滴定管量取20.00 mLKMnO4溶液 |
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释 |
| A | 在密闭容器中加热CuO | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
| B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
| D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.检验亚硫酸钠试样是否变质: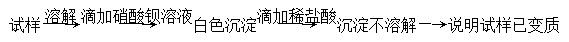 |
B.除去粗盐中含有的硫酸钙杂质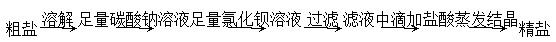 |
C.检验某溶液中是否含有Fe2+ |
| D.证明酸性条件H2O2的氧化性比I2强: |
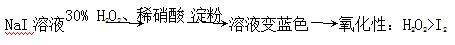
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 | 石灰水变浑浊 | W可能是Na2CO3 |
| B | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | X一定是浓盐酸 |
| C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀, 后溶液又变红 | Y中一定含有SO42-和Fe3+ |
| D | 少量气态炔烃Z通入pH=a的溴水中 | 溴水褪色,溶液的pH仍约为a | Z与溴发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
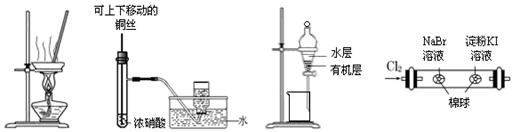
| A.用图1所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
| B.用图2所示装置,制备并收集少量NO2气体 |
| C.用图3所示装置,分离CCl4萃取I2水后的有机层和水层 |
| D.用图4所示装置,可以证明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
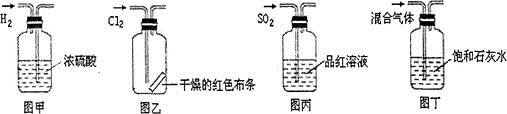
| A.图甲所示,可得到干燥的氢气 |
| B.图乙所示,可以验证氯气的漂白性 |
| C.图丙所示,可以验证SO2的漂白性 |
| D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
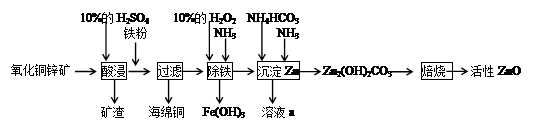
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
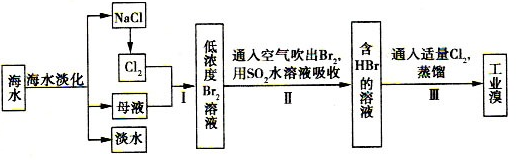
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
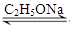 CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
| | 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138. 4 | 76.8 |
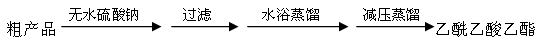
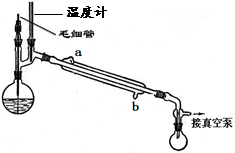
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com