
| A. | 2.24g | B. | 3.36g | C. | 5.60g | D. | 10.08g |
分析 完全反应后滤液中没有Cu2+,说明溶液中也没有Fe3+,则溶液中阳离子有Fe2+和H+,溶质为FeCl2和HCl,
根据电荷守恒得2n(Fe2+)+n(H+)=n(Cl-),则n(Fe2+)=$\frac{4.40mol/L×0.1L-0.40mol/L×0.2L}{2}$mol=0.18mol,生成n(H2)=$\frac{0.896L}{22.4L/mol}$=0.04mol,因为还有盐酸剩余,溶液残留固体是Cu,n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,
设Fe的物质的量为xmol、Fe2O3的物质的量为ymol,
根据Fe原子守恒得x+2y=0.18
根据转移电子守恒得2x=0.04×2+0.02×2+2y×1,
从而计算n(Fe),根据m=nM计算铁的质量.
解答 解:完全反应后滤液中没有Cu2+,说明溶液中也没有Fe3+,则溶液中阳离子有Fe2+和H+,溶质为FeCl2和HCl,
根据电荷守恒得2n(Fe2+)+n(H+)=n(Cl-),则n(Fe2+)=$\frac{4.40mol/L×0.1L-0.40mol/L×0.2L}{2}$mol=0.18mol,生成n(H2)=$\frac{0.896L}{22.4L/mol}$=0.04mol,因为还有盐酸剩余,溶液残留固体是Cu,n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,
设Fe的物质的量为xmol、Fe2O3的物质的量为ymol,
根据Fe原子守恒得x+2y=0.18
根据转移电子守恒得2x=0.04×2+0.02×2+2y×1,
解得x=0.10、y=0.04,
所以m(Fe)=0.10mol×56g/mol=5.60g,
故选C.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确溶液中的溶质是解本题关键,根据原子守恒、转移电子守恒进行计算,能化繁为简,提高效率.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g O2含有电子数目为4NA | |
| B. | 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA | |
| C. | 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA | |
| D. | 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与其他分散系的本质区别是丁达尔效应 | |
| B. | 氨气属于非电解质,Cu属于电解质 | |
| C. | Na2CO3溶液显碱性,说明Na2CO3属于碱 | |
| D. | 二氧化碳和二氧化硫都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在25℃,1.01×105Pa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
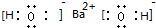 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | SiH4和H2S | C. | NaCl和HCl | D. | CCl4和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素原子半径越大,氢化物越稳定 | |
| B. | 卤素原子半径越大,氢化物越不稳定 | |
| C. | 卤素氢化物稳定性:HF>HCl>HBr>HI | |
| D. | 卤族单质与氢气越难反应,生成的氢化物越不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
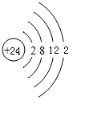 As
As
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com