
��2011?˳����ģ�⣩��1����-50��ʱ��Һ���������µ��룺2NH
3?NH
4++NH
-2��k=2��10
-12��Һ���ĵ���ﵽƽ��ʱ��������Ũ�ȴ�С��ϵΪ
c��NH3����c��NH4+��=c��NH2-��
c��NH3����c��NH4+��=c��NH2-��
������NH
4Cl���壬K
=
=
2��10
-12�����������������=����
��2����֪25��ʱKsp��AgCl��=1.8��10
--10����10mL 0.10mol/L AgNO
3��Һ�м���10mL0.20mol/LNaCl��Һ����ַ�Ӧ����Һ�е�c��Ag
+��=
3.6��10-9mol/L
3.6��10-9mol/L
��
��3����ƽ����������ǿ���Ʊ����������������ֳ���������Ļ�ѧ����ʽ��
2
2
FeSO
41
1
Fe
2O
3+
1
1
SO2��
SO2��
+
1
1
SO3��
SO3��
��4����֪����������ˮ����Һ�����ԣ���ͼ��ʾ������ʵ��װ���У���Һ�������Ϊ200mL����ʼʱ�������Һ��Ũ�Ⱦ�Ϊ0.1mol/L������һ��ʱ���õ����о�ͨ��0.02mol���ӣ����������ε�ˮ�����Һ����ı仯����������������ȷ����
BC
BC
A�����������������٣���
B����Һ��pH�仯���ټ�С��������
C���缫���������ʵ��������٣���
D���缫��Ӧʽ���������� 2Cl
--2e
-?Cl
2�� ����� 2H
++2e
-?H
2��

 ��2011?˳����ģ�⣩��1����-50��ʱ��Һ���������µ��룺2NH3?NH4++NH-2��k=2��10-12��Һ���ĵ���ﵽƽ��ʱ��������Ũ�ȴ�С��ϵΪ
��2011?˳����ģ�⣩��1����-50��ʱ��Һ���������µ��룺2NH3?NH4++NH-2��k=2��10-12��Һ���ĵ���ﵽƽ��ʱ��������Ũ�ȴ�С��ϵΪ


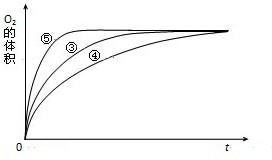 ��2011?˳����ģ�⣩ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�죮�ڳ����°������·������ʵ�飮
��2011?˳����ģ�⣩ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�죮�ڳ����°������·������ʵ�飮