
【题目】25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示。下列说法正确的是

A. 溶解度S(FeS)<S(ZnS)
B. a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-)
C. 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液
D. 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同主族,B和 D同主族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是_____(填元素符号)。
(2)写出与D同主族元素的氢化物中沸点最髙的物质电子式_______。
(3)单质E与水反应的产物中具有强氧化性物质的结构式_______。
(4)A和E形成的化合物与A和B形成的化合物反应,产物中存在的化学键类型为_______。
(5)C与氧气燃烧的产物投入到水中发生反应的离子方程式为_______。
(6)由A和B、D、E所形成的共价型化合物中,热稳定性最差的物质在足量氧气中燃烧,写出燃烧的化学方程式________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中正确的是
A. 同一原子中,能层序数越大,s原子轨道的形状相同,半径越大
B. 在同一能层上运动的电子,其自旋方向肯定不同
C. 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D. 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某种软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)为主要原料生产KMnO4的一种流程图如下:
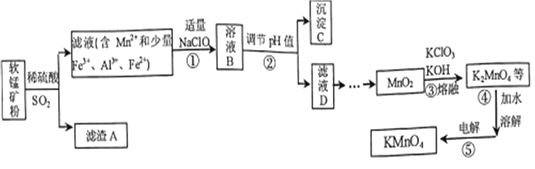
已知:Mn(OH)2极易被空气氧化;Fe(OH)3、Al(OH)3的溶度积常数依次为4.0×10-38、1.3×10-33。
(1)滤渣A的化学式是_________;溶液B中的主要阴离子有______________。
(2)为避免引入杂质,②步调节pH加入的物质是____________;调节pH除杂过程中,后析出的
沉淀是________________。
(3)浓硫酸与MnO2反应也能生成Mn2+,其化学方程式是___________________。
(4) K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,则③步原料应保证_______________。
④步溶解水应煮沸的目的是_____________________。
(5)⑤步的阳极电极反应式是____________;该法电解时要产生污染,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中能大量共存的离子组是( )
A. Ca2+、Na+、NO3-、CO32- B. Na+、Cl-、NH4+、SO42-
C. K+、Cl-、HCO3-、NO3- D. Ca2+、Na+、Fe3+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向K2SO4和FeCl3混合溶液中滴入Ba(OH)2溶液,当SO42-离子完全沉淀时,Fe3+也同时被完全沉淀,则原混合溶液中K2SO4和FeCl3的物质的量浓度之比为( )
A. 1:1 B. 2:1 C. 3:1 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+ Cl-+3H+。己知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是 ( )

A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 图中阴影部分的面积表示t1~t2时间内ClO3-的物质的量的减少量
D. 后期反应速率下降的主要原因是反应物浓度减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com