
| A. | CH3CH2OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| C. | 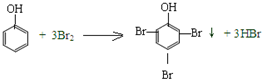 | |
| D. | CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O |
分析 消去反应是指在一定条件下,有机物脱去小分子生成分子中含有双键的不饱和有机物的反应;
取代反应指有机化合物分子中原子或原子团被其它原子或原子团所取代的反应;
加成反应指有机物分子中的不饱和双键或叁键发生断裂,不饱和原子与其它原子或原子团直接结合生成新化合物的反应.
解答 解:根据取代反应、加成反应和消去反应概念知,ACD属于取代反应,且A还属于酯化反应,只有B属于消去反应,则有一种变化与其他三种变化类型不同的是B,故选B.
点评 本题考查有机物结构和性质,侧重考查学生对基本概念的分析判断,明确取代反应、消去反应概念区别是解本题关键,知道常见有机反应类型特点,注意:酯的水解反应、卤代烃的水解反应、酯化反应都属于取代反应.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Z | |
| B. | W的气态氢化物的热稳定性比Y的强 | |
| C. | Z与W形成的是离子化合物 | |
| D. | W的最高价氧化物对应水化物酸性比R的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
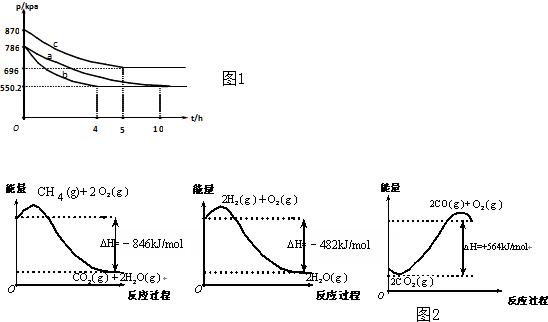
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
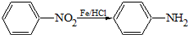 (苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.
(苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.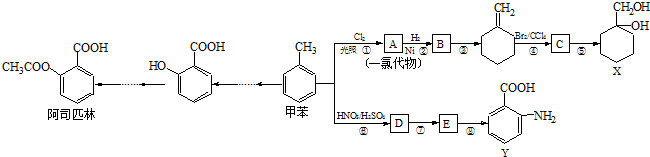
 ,C
,C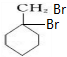 ,E
,E .
.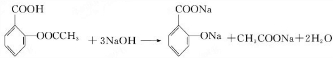 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中半径最小的元素,W与Y组成的化合物是温室气体、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中半径最小的元素,W与Y组成的化合物是温室气体、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该氢化物可以与H+离子以配位键相合,产物的结构式
,该氢化物可以与H+离子以配位键相合,产物的结构式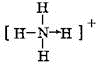 .
. ,1mol O22+中含有的π键为2mol.
,1mol O22+中含有的π键为2mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
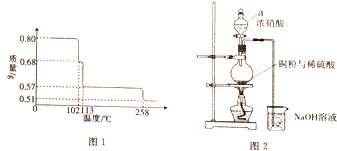 硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:
硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、AlO2-、CrO42-、CO32- | B. | Na+、AlO2-、CO32- | ||
| C. | Na+、AlO2-、CO32-、SO42- | D. | Na+、Ba2+、AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com