
室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
A.II表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)= 20.00 mL时,两份溶液中c(Cl-)= C(CH3COO-)
D.V(NaOH) =10.00 mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)

科目:高中化学 来源: 题型:
有些食品的包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)写出生石灰可做干燥剂的理由。
(3)生石灰还可以与哪类物质发生化学反应?列举三例,并写出化学方程式。
(4)小纸袋中的物质能否长期持续地做干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些物质可做干燥剂?举例说明。
查看答案和解析>>
科目:高中化学 来源: 题型:
将KCl和KBr的混合物13.4 g溶于水配成500 mL溶液,通入过量的Cl2,反应后将溶液蒸干,得固体11.175 g,则原来所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )
A.1∶2∶3 B.3∶2∶1
C.1∶3∶2 D.2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
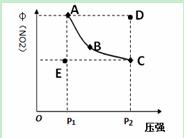
对于反应:N2O4(g)2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的对应压强下的平衡点),下列说法正确的是
A.A、C两点的正反应速率的关系为v(A)>v(C)
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时
间为y,则:x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上讲可选用的条件是从P1突然加压到P2,再由P2无限缓慢降压到P1
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.10mol·L-1的盐酸滴定0.10mol·L-1的氨水,滴定过程中不可能出现的结果是
A.c(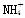 )>c(Cl-),c(OH-)>c(H+) B.c(
)>c(Cl-),c(OH-)>c(H+) B.c(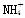 )=c(Cl-),c(OH-)=c(H
)=c(Cl-),c(OH-)=c(H
C.c(Cl-)>c(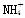 ),c(OH-)>c(H+) D.c(Cl-)>c(
),c(OH-)>c(H+) D.c(Cl-)>c(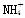 ),c(H+)>c(OH-)
),c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 初始读数(mL) | 0.40 | 0.10 | 0.90 | 0.00 |
| 最终读数(mL) | 25.05 | 20.10 | 21.00 | 19.90 |
| V标(mL) | 24.65 | 20.00 | 20.10 | 19.90 |
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________ ②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液 B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是
A.NaOH溶液存放在带橡胶塞的细口玻璃瓶中
B.氯水存放在棕色细口玻璃瓶中,并置于冷暗处
C.浓硫酸存放在带橡胶塞的细口玻璃瓶中
D.金属钠用煤油液封于广口玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com