
【题目】下列说法正确的是
A. (CH3)3CCH2(CH3)C=CH2的名称为:2,2,4-三甲基-4-戊烯
B. 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种(不考虑顺反异构)
C. 1mol有机物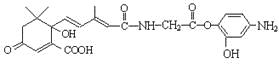 与NaOH溶液反应,最多消耗5molNaOH
与NaOH溶液反应,最多消耗5molNaOH
D. 1molβ-紫罗兰酮( )与1molHBr发生加成反应可得到3种不同产物
)与1molHBr发生加成反应可得到3种不同产物
【答案】C
【解析】试题分析:A、烯烃的命名中,从离双键最近的碳原子开始编号,其名称为:2,4,4-三甲基-1-戊烯,A错误;B、对称烯烃与不对称分子加成后产物只有1种,所以碳原子数小于或等于8的某单烯烃与HBr反应,其加成产物只有一结构,符合此条件的单烯烃有CH2=CH2、CH3-CH=CH-CH3、CH3CH2CH=CHCH2CH3、(CH3)2C=C(CH3)2,共4种,B错误;C、有机物中的肽键、酯基、羧基、酚羟基等都可以消耗氢氧化钠,酯基是酚羟基和羧基掉水形成的酯基,可以消耗2mol氢氧化钠,其余均消耗1mol氢氧化钠,共消耗5mol氢氧化钠,C正确;D、1mol β-紫罗兰酮与1mol HBr发生加成反应可得到6不同产物,其中1,2加成四种,1,4加成两种,D错误,答案选C。


科目:高中化学 来源: 题型:
【题目】下列氢化物中稳定性有强到弱的顺序正确的是( )
A. CH4>NH3>H2O>HF B. SiH4>NH3>H2S>HCl
C. HF> H2O>NH3>PH3 D. NH3>PH3> H2S>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图:
请回答:
(1)若C的焰色反应为黄色;常温下,D为无色气体,能参与绿色植物的光合作用.
①组成A的元素在周期表中的位置是 .
②下列叙述正确的是 (填字母).
a.A与冷水剧烈反应
b.C与水反应可生成B
c.E与酸反应可生成D
(2)若C是能使湿润的红色石蕊试纸变蓝的气体,D是黄绿色气体.
①C与D反应的化学方程式是 .
②上述反应中转移1.2mol电子时,生成B的体积为 (标准状况).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是( )

A. 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
B. 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C. 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
D. 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 用括号中的试剂和方法除去各物质中的少量杂质,正确的是
A.苯中的甲苯(溴水、分液)
B.乙醇中的乙酸(NaOH溶液,分液)
C.乙醇中的水(新制CaO,蒸馏)
D.乙酸乙酯中的乙酸(NaOH溶液,分液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:

(1)Ti元素原子序数为22,它在元素周期表中的位置是第 周期第 族;其基态原子的电子排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图1所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 。
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点﹣23.2℃,沸点136.2℃,所以TiCl4应是
化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图2所示,我们通常可以用图3所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请将其结构画出_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的泄漏会造成严重的危险,以下说法有科学性错误的是
A. 由于大量苯溶入水中,渗入土壤,会对周边农田、水源造成严重的污染
B. 由于苯是一种易挥发、易燃的物质,周围地区如果有火星就可能引起爆炸
C. 可以采取抽吸水渠中上层液体的办法,达到部分清除泄漏物的目的
D. 由于苯有毒,所有工作人员在处理事故时,都要做相关防护措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4==="2" KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com