
【题目】![]() 广泛用作有机反应催化剂。十堰市采用镁屑与液溴为原料制备无水
广泛用作有机反应催化剂。十堰市采用镁屑与液溴为原料制备无水![]() ,装置如图1,主要步骤如下:
,装置如图1,主要步骤如下:
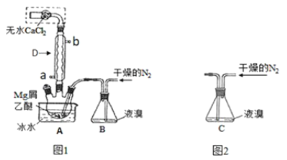
步骤1:三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三口瓶中。
步骤3:反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水![]() 产品。
产品。
已知:①![]() 和
和![]() 剧烈反应,放出大量的热;
剧烈反应,放出大量的热;![]() 具有强吸水性;
具有强吸水性;
②乙醚![]() 极易挥发;
极易挥发;
③![]()
![]()
请回答下列问题:
(1)仪器D的作用是__________;
(2)无水![]() 的作用是__________。
的作用是__________。
(3)步骤2通入干燥的![]() 的目的是______;实验中不能用干燥空气代替干燥
的目的是______;实验中不能用干燥空气代替干燥![]() ,原因是________。
,原因是________。
(4)若将装置B改为装置C(图2),可能会导致的后果是______
(5)步骤4用苯溶解粗品的目的是_________。
(6)从平衡移动的角度解释得到三乙醚合溴化镁后,加热有利于得到无水![]() 产品的原因:_________
产品的原因:_________
【答案】冷凝回流 防止空气中的水蒸气进入A 装置 将溴蒸汽吹出 镁屑会与空气中的氧气反应,生成的![]() 阻碍反应的继续进行 会将液溴挤压入A中,剧烈反应,放出大量热,存在安全隐患 除去溴、乙醚等杂质 该反应为放热反应,且加热促使乙醚挥发,加热后平衡逆向移动
阻碍反应的继续进行 会将液溴挤压入A中,剧烈反应,放出大量热,存在安全隐患 除去溴、乙醚等杂质 该反应为放热反应,且加热促使乙醚挥发,加热后平衡逆向移动
【解析】
(1)乙醚和溴都易挥发,据此分析作用;
(2)MgBr2具有强吸水性,据此分析;
(3)根据溴单质具有挥发性分析;空气中的氧气与Mg反应;
(4)将装置B改为装置C,会将液溴挤压入三口瓶中,而Mg和Br2反应剧烈放热;
(5)粗品含有溴和乙醚等杂质,需要除去;
(6)已知:MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5△H<0,加热有利于吸热方向,同时乙醚会挥发,据此分析。
(1)仪器D为球形冷凝管,作用是使挥发出的乙醚和溴蒸气冷却并回流至反应装置;
(2)![]() 具有强吸水性,无水
具有强吸水性,无水![]() 的作用是防止空气中的水蒸气进入A 装置;
的作用是防止空气中的水蒸气进入A 装置;
(3)因为液溴极易挥发,故干燥的N2可将液溴吹出;镁屑会与空气中的氧气反应,生成的MgO阻碍反应的继续进行,故实验中不能用干燥空气代替干燥N2;
(4)已知:Mg和Br2反应剧烈放热,将装置B改为装置C,会将液溴挤压入三口瓶中,反应加剧大量放热存在安全隐患;
(5)步骤4用苯溶解粗品的目的是除去溴、乙醚等杂质;
(6)已知MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5 △H<0,加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解的方向移动。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】已知热化学方程式:则下列说法正确的是
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )

A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表的一部分,根据A~I在周期表中的位置,回答以下问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是__(用元素符号表示,本小题下同);被选做相对原子质量标准的核素是__(填核素符号);除稀有气体外,原子半径最大的是__,可用于制半导体材料的元素是__,形成化合物中种类最多的元素是__。
(2)最高价氧化物的水化物酸性最强的是__(填化学式),A分别与D、E、F、G、H形成的化合物中,最稳定的是__(填化学式)。
(3)B和H形成化合物的电子式为_。
(4)元素E和元素H的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式__。
(5)B、C两元素的最高价氧化物对应水化物之间反应的离子方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,该药物通常以 2-氯苯甲醛为原料合成,合成路线如下:
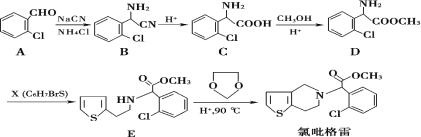
(1)下列关于氯吡格雷的说法正确的是__________。
A.氯吡格雷在一定条件下能发生消去反应
B.氯吡格雷难溶于水,在一定条件下能发生水解反应
C.1mol氯吡格雷含有5NA个碳碳双键,一定条件下最多能与5molH2发生加成反应
D.氯吡格雷的分子式为C16H16ClNO2S
(2)物质 D 的核磁共振氢谱有_________种吸收峰。
(3)物质 X 的结构简式为____________。
(4)物质 C可在一定条件下反应生成一种含有 3个六元环的产物,写出该反应的化学方程式______,反应类型是__________。
(5)写出属于芳香族化合物 A的同分异构体__________(不包含 A)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃处为SO2气体发生装置,C处为SO2与O2反应的装置。
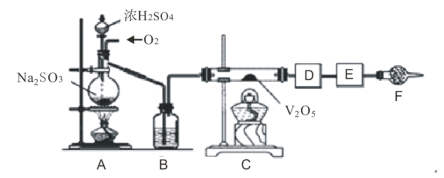
完成下列填空:
(1)A处的化学反应方程式为___,所用的硫酸一般为___(此处填98%的硫酸溶液、70%的硫酸溶液或30%的硫酸溶液)。
(2)根据实验需要,应该在D、E处连接合适的装置。请从图中选择,将所选装置的序号填入相应的空格,D:___,E:____。

(3)用12.6gNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间![]() ,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为____%。
,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为____%。
(4)若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是___。
(5)以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是
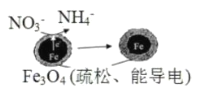
A.能量转化形式主要为化学能转化为电能
B.该原理的总反应可表示为NO3-+3Fe+2H++H2O=NH4++Fe3O4
C.电极材料分别为Fe和Fe3O4
D.负极反应为NO3-+8e-+10H+=NH4++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO· FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
I.配制酸性KMnO4标准溶液:下图是配制50 mL酸性KMnO4标准溶液的过程示意图。
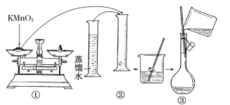
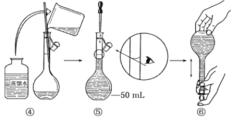
(1)请你观察图示并判断其中不正确的操作有______________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________________(填名称)。
(3)如果按照图示的操作配制溶液,在其他操作均正确的情况下,配制溶液的浓度将______(填“偏大”或“偏小”)。
II.测定血液样品中Ca2+的浓度:取血液样品20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1酸性 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)请写出草酸与酸性KMnO4溶液反应的离子方程式 ____________________________。
(5)滴定时,根据现象_________________________,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为______________mg·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com