
| 5 |
| 4 |
| 1 |
| 4 |
| 5 |
| 4 |
| 1 |
| 4 |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
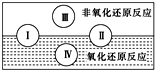 Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
| ||
4- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在稀硫酸中加入铜粉,铜粉不溶解;再加入K NO3 固体,铜粉仍不溶解 |
| B、将等物质的量Cl2与SO2通入品红溶液,漂白性增强 |
| C、浓H2SO4与Cu或C反应都需加热,浓硝酸与Cu或C反应都不需加热 |
| D、铝、氧化铝、小苏打、醋酸铵都既能与盐酸又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,某难溶物的Ksp为2.5×105 | ||||
| B、反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | ||||
C、NH3?H2O溶液加水稀释后,溶液中
| ||||
| D、常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
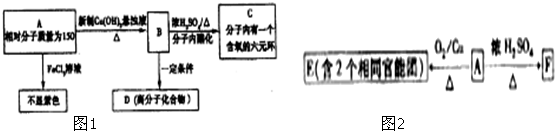
查看答案和解析>>
科目:高中化学 来源: 题型:
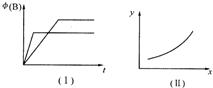
| A、若甲为恒容体系,图象(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B、恒温条件下,图象 (Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C、恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2molA,乙中充入1molB、3molC,则达到平衡后两容器中B的体积分数一定不同 |
| D、恒温条件下,乙容器存在图象 (Ⅱ)的关系,则当x代表压强时,y可代表B的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2LH2和0.5molCO2 |
| B、18mLH2O(4℃)和2ⅹ105Pa,27℃32gO2 |
| C、1molCO和88gCO2 |
| D、27℃,22.4LCl2和含4mol氧原子的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
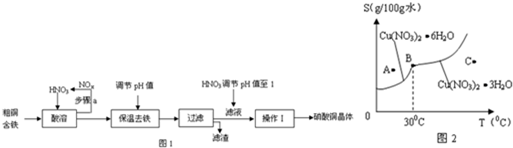
| 氢氧化物开始沉淀时的pH | 氢氧化物开始沉淀时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com