
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
并知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。
下列叙述正确的是( )
A.P-P键的键能小于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
如图是立方烷的键线式结构,下列有关说法不正确的是
( )

A.它和苯的最简式相同
B.它属于芳香烃
C.它只有两种化学键
D.它与苯乙烯(C6H5—CH===CH2)具有相同的分子式
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为1∶1∶6。下列有关该溶液的判断正确的是( )
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀氢氧化钠溶液,立即出现红褐色沉淀
C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为1
D.向该溶液中加入过量铁粉,只发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)10Be和9Be________。
a.是同一种原子
b.具有相同的中子数
c.具有相同的化学性质
(2)Al和Be具有相似的化学性质,写出BeCl2水解反应的化学方程式_______________。
(3)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是_________
_______________________________________________________________。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中 放置已久的这两种元素的单质分别和热水作用
放置已久的这两种元素的单质分别和热水作用
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序________(用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干燥剂,此化合物的电子式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)===H2O(l);ΔH= -57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量为57.3 kJ
C.由C(石墨)―→C(金刚石);ΔH=+73 kJ/mol,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l);ΔH=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的转化通过一步反应不能实现的是 ( )
A.HCl →Cl2→HClO→NaClO B.Na→Na2O2→Na2CO3→NaHCO3
C.Si→SiO2→H2SiO3→Na2SiO3 D.Al→NaAlO2 →Al(OH)3→Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请回答下列问题:
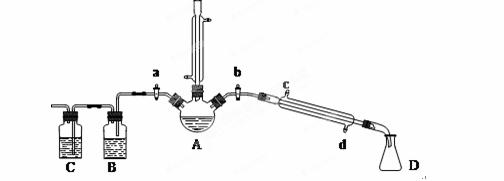
(1)仪器A的名称是 。
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。写出该反应的化学方程式 。
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是 、 。
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为 ,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气。
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
为了进一步精制1-溴丁烷,继续进行了如下实验:待烧瓶冷却后,拔去竖直的冷凝管,塞上带温度计的橡皮塞,关闭a,打开b,接通冷凝管的冷凝水,使冷水从 (填c或d)处流入,迅速升高温度至 ℃,收集所得馏分。
(6)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com