
| A. | 若2分钟达到化学平衡时N2还剩下0.4mol,则v(N2)=0.3mol/(L•min) | |
| B. | 达到化学平衡时,单位时间内每生成0.1mol的H2同时生成0.1mol的NH3 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡后,若增大压强使容器体积缩小,化学反应速率将会增大 |
分析 A、根据v(N2)=$\frac{△c}{△t}$进行计算;
B、转化为同种物质的反应速率,判断正逆反应速率的关系,正逆反应速率相等达到化学平衡状态;
C、1molN2和3molH2混合进行反应不能完全转化;
D、增大压强使容器体积缩小,则增大单位体积内的活化分子数目,所以化学反应速率将会增大.
解答 解:A.若2分钟达到化学平衡时N2还剩下0.4mol,则消耗的氮气为1-0.4=0.6mol,所以v(N2)=$\frac{△c}{△t}$,未指明体积,则无法计算速率,故A错误;
B.单位时间内生成0.1mol的H2,同时生成0.1mol的NH3,由化学计量数之比等于化学反应速率之比,则氢气的正逆反应速率不等,该反应没有达到平衡状态,故B错误;
C.达到化学平衡时,正逆反应速率相等,N2、H2和NH3的物质的量浓度不再变化,故C正确;
D.达增大压强使容器体积缩小,则增大单位体积内的活化分子数目,所以化学反应速率将会增大,故D正确.
故选AB.
点评 本题考查较为综合,涉及可逆反应反应速率的计算、反应速率的影响因素以及化学平衡状态的判断,题目难度不大,注意把握可逆反应的特点以及平衡状态的标志.


科目:高中化学 来源: 题型:选择题
| A. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗 4 Na+O2=2Na2O | |
| C. | 燃煤中加入石灰石可以减少SO2的排放:O2+2CaCO3+2SO2=2CO2+2CaSO4 | |
| D. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的简单阴离子比W的简单阴离子还原性强 | |
| C. | Y与Z形成的化合物都可以和盐酸反应 | |
| D. | Q形成的含氧酸一定比W形成的含氧酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

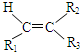 $→_{ⅱZn/H_{2}O}^{ⅰO_{3}}$ R1CHO+
$→_{ⅱZn/H_{2}O}^{ⅰO_{3}}$ R1CHO+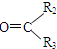
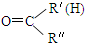 $\stackrel{一定条件下}{→}$ R-
$\stackrel{一定条件下}{→}$ R-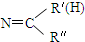 +H2O
+H2O .
.

 .
.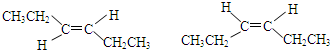 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
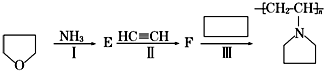
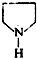 ,F
,F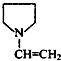
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和NH3的质量分数相等 | B. | N2、H2、NH3的浓度之比为1:3:2 | ||
| C. | 反应物和生成物浓度不再发生变化 | D. | 正反应和逆反应不再进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
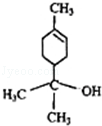
| A. | 松油醇的分子式为C10H20O | |
| B. | 松油醇分子在核磁共振氢谱中有7个吸收峰 | |
| C. | 它属于芳香醇 | |
| D. | 松油醇能发生消去反应、还原反应、氧化反应、酯化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com