


分析 含有Fe2O3、SiO2的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)加硫酸,在90℃温度下,溶解,过滤,滤液中含有FeSO4(aq)、TiOSO4(aq)和Fe2(SO4)3(aq),加铁粉(试剂A),把三价铁离子还原为亚铁离子,降温到70℃,结晶过滤,得到硫酸亚铁晶体,滤液为TiOSO4(aq),滤液温度升高到90℃,使TiOSO4水解生成H2TiO3固体,洗涤、干燥、煅烧得到TiO2;
(1)由流程可知,温度高会促进TiOSO4水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而进入绿矾晶体,损失钛元素;
(2)根据亚铁离子的检验操作和现象分析,亚铁离子遇到KSCN溶液不变红色,遇到氧化剂会出现红色证明亚铁离子的存在;根据Fe2O3的颜色分析,H2TiO3中的二价铁易被氧化为三价铁,煅烧时会生成Fe2O3;
(3)根据物质的性质和质量守恒定律书写化学方程式,设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),配平得到化学方程式;
(4)检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在氯离子;
(5)A.钛在高温下可能易与氧气反应生成二氧化钛;
B.镁易熔化熔点较低;
C.活泼性强的金属能置换活泼性弱的金属;
D.电解熔融的MgCl2能制取镁;
(6)TiO2、Cl2和焦炭在高温条件下生成TiCl4和CO2,再用Mg单质置换TiCl4得到Ti和MgCl2,电解熔融的氯化镁又能得到Mg和氯气.
解答 解:含有Fe2O3、SiO2的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)加硫酸,在90℃温度下,溶解,过滤,滤液中含有FeSO4(aq)、TiOSO4(aq)和Fe2(SO4)3(aq),加铁粉(试剂A),把三价铁离子还原为亚铁离子,降温到70℃,结晶过滤,得到硫酸亚铁晶体,滤液为TiOSO4(aq),滤液温度升高到90℃,使TiOSO4水解生成H2TiO3固体,洗涤、干燥、煅烧得到TiO2;
(1)由流程可知,试剂A为铁粉;由题中信息可知,TiOSO4容易水解,升高温度促进水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低;
故答案为:铁粉;由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低;
(2)取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,说明没有Fe3+,再加H2O2后出现红色,说明有Fe3+,则原来含有Fe2+,加H2O2后Fe2+被氧化为Fe3+;H2TiO3中的二价铁易被氧化为三价铁,煅烧时会生成Fe2O3,TiO2含有少量的Fe2O3会呈现黄色;
故答案为:Fe2+;Fe2O3;
(3)设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl,
故答案为:TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;
(4)沉淀吸附溶液中的Cl-,根据发生反应:Cl-+Ag+═AgCl↓,取最后一次的少量洗涤液,检验溶液中溶解的离子是否还存在,
故答案为:取最后一次的少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(5)A.工业制备金属钛是在800~900℃及惰性气体的保护下,说明钛在高温下可能易与氧气反应生成二氧化钛,故A正确;
B.镁易熔化熔点较低,镁的熔点比钛的熔点低,故B错误;
C.活泼性强的金属能置换活泼性弱的金属,Mg能置换Ti,说明Mg比Ti活泼,故C错误;
D.电解熔融的MgCl2能制取镁,所以反应②产生的MgCl2可作为电解法制取镁的原料,故D正确;
故答案为:BC;
(6)TiO2、Cl2和焦炭在高温条件下生成TiCl4和CO2,再用Mg单质置换TiCl4得到Ti和MgCl2,电解熔融的氯化镁又能得到Mg和氯气,则以TiO2、Cl2和焦炭为原料制取金属Ti和Mg的流程图为: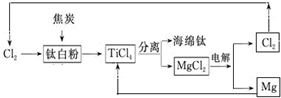 ,
,
故答案为: .
.
点评 本题考查学生对工艺流程理解、阅读题目获取信息能力、离子检验、水解原理的应用及方程式的书写等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化的主要目的是为了提高轻质油的质量和产量 | |
| B. | 石油分馏所得到的馏分是一种具有固定熔沸点的纯净物 | |
| C. | 可燃冰、干冰和冰的主要化学成分相同 | |
| D. | 石油的裂化、分馏、裂解等都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既是离子键、又有非极性共价键 | |
| B. | 既有极性共价键,又有非极性共价键 | |
| C. | 都是非极性共价 | |
| D. | 都是极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
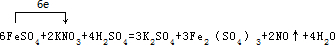 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com